抗體藥物臨床研究項目可行性研究報告
思瀚產(chǎn)業(yè)研究院 百利天恒 2022-12-30
1����、項目概況
公司確立了聚焦抗腫瘤創(chuàng)新抗體藥物的長期戰(zhàn)略,并著眼全球視野下研發(fā)能力的提升�����。根據(jù)公司在研產(chǎn)品結(jié)構(gòu)和未來研發(fā)計劃�����,擬使用 110,852.55 萬元用于創(chuàng)新藥物的臨床研究���,包括公司 5個重點在研品種的共計 17 個臨床研究��,以支持這些品種的上市申請或進一步開展后續(xù)更大規(guī)模的確證性臨床研究等��。
其中��,多特生物將承擔“腫瘤治療領域創(chuàng)新抗體類藥物研發(fā)項目”�����,包括 4個創(chuàng)新抗體合計 16 個臨床試驗的開展����。百利藥業(yè)將承擔“新冠治療領域創(chuàng)新抗體類藥物研發(fā)項目”�,將開展 1 個創(chuàng)新抗體藥物的 1 個臨床試驗����。
本項目將推動公司創(chuàng)新藥物的研發(fā)進程�����,豐富公司在研藥物產(chǎn)品管線��,為促進臨床前藥品的研發(fā)����、推進臨床階段藥品的國際多中心臨床試驗、加快核心產(chǎn)品NDA 申報奠定基礎�����,從而擴展公司面向的市場領域����,擴大公司的發(fā)展空間。
2�、項目投資概算
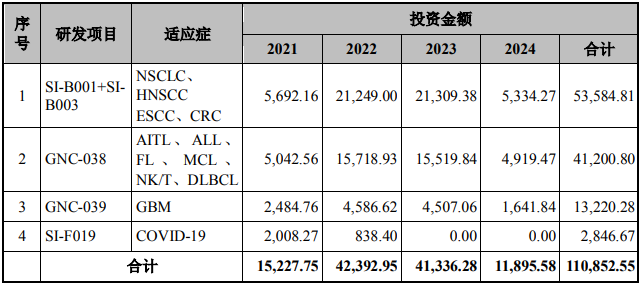
本項目開展的研發(fā)方向和對應投資概算如下表所示:萬元
注 1:NSCLC:非小細胞肺癌�����;HNSCC:頭頸鱗癌;ESCC:食管鱗癌����;CRC:結(jié)直腸癌;ALL:急性淋巴細胞白血?���。籄TIL:血管免疫母細胞性T 細胞淋巴瘤�;FL:濾泡性淋巴瘤;MCL:套細胞淋巴瘤��;NK/T:自然殺傷細胞或 T 細胞淋巴瘤����;DLBCL:彌漫大 B細胞淋巴瘤;GBM:腦膠質(zhì)瘤����;COVID-19:新型冠狀病毒肺炎
注 2:上述各研發(fā)項目和研發(fā)項目內(nèi)不同適應癥之間可根據(jù)發(fā)行人臨床研究進展和實際情況所需進行適當調(diào)整
3、項目實施的必要性
(1)加快公司創(chuàng)新藥物研發(fā)進程�,拓展公司產(chǎn)品的應用領域
公司自 2011 年以來,持續(xù)進行重大疾病領域創(chuàng)新生物藥的研發(fā)�����,在發(fā)現(xiàn)及開發(fā)創(chuàng)新抗體生物領域能力突出,能夠獨立進行生物藥開發(fā)所需的靶點評估���、機制研究�、藥物分子合成與篩選以及功能學驗證等全流程環(huán)節(jié)��。本次募集資金將重點用于雙特異性抗體藥物�����、四特異性抗體藥物����、融合蛋白類藥物后續(xù)的境內(nèi)臨床研發(fā)。
公司已制定了在研創(chuàng)新藥物在多個適應癥上的臨床試驗計劃�����,以推動完成創(chuàng)新藥從概念驗證�、動物試驗和臨床治療應用的完整研發(fā)過程。創(chuàng)新藥臨床試驗監(jiān)管嚴格����,過程周期較長�,試驗復雜���,對企業(yè)的資金投入有著較高要求,本項目使用募集資金投入到臨床試驗當中��,將加快公司創(chuàng)新藥物的研發(fā)進程����,拓展公司在研藥物的臨床試驗廣度和深度,為公司實現(xiàn)更多可商業(yè)化的產(chǎn)品奠定基礎�。
(2)落地重大技術(shù)成果,鞏固公司競爭優(yōu)勢
公司的雙特異抗體 SI-B001�、SI-B003 分別于 2019 年 11 月、2020 年 1 月獲得臨床試驗通知書�。公司的四特異性抗體 GNC-038、GNC-039 分別于 2020 年 9月��、2020 年 12 月獲得臨床試驗批準通知書��。公司的融合蛋白藥物 SI-F019 于 2021年 3 月獲得臨床試驗通知書�。其中,GNC-038�����、GNC-039 是全球前 2 個進入臨床研究階段的四特異性抗體藥物,SI-F019 可用于新冠肺炎病毒 COVID-19 的防治���。
SI-B001��、SI-B003����、GNC-038��、GNC-039���、SI-F019 將在非小細胞肺癌����、彌漫大 B 細胞淋巴瘤��、頭頸鱗癌���、腦膠質(zhì)瘤�、新冠肺炎等適應癥上開展 II 期/III 期等臨床試驗�����,并進行注冊性試驗和適應癥的拓展,從而推動公司的重大技術(shù)成果向產(chǎn)業(yè)化的方向邁進�。相關(guān)試驗也有助于公司進一步積累雙多特異性抗體的臨床經(jīng)驗,并鞏固公司在此藥物領域上的競爭優(yōu)勢���。
(3)增強核心競爭力�����,為公司增長提供持續(xù)動力
研發(fā)是創(chuàng)新藥企業(yè)的發(fā)展基石和核心競爭力。醫(yī)藥行業(yè)屬技術(shù)密集型產(chǎn)業(yè)���,產(chǎn)品生命周期有限��,技術(shù)迭代升級較快���,創(chuàng)新藥企業(yè)為保持競爭優(yōu)勢,不斷拓展研發(fā)管線����,增強研發(fā)的深度和廣度,為持續(xù)增長�����、增強核心競爭力提供保障。全球醫(yī)藥行業(yè)的龍頭企業(yè)持續(xù)進行大量的研發(fā)投入進行創(chuàng)新產(chǎn)品開發(fā)�,以創(chuàng)造新的增長點,保持競爭力與行業(yè)領導地位��。
我國醫(yī)藥行業(yè)近年來研發(fā)投入力度不斷加大�����,傳統(tǒng)制藥企業(yè)和創(chuàng)新藥物企業(yè)紛紛開展了一系列接軌國際技術(shù)水平的創(chuàng)新藥物研發(fā)�,帶動行業(yè)技術(shù)水平快速提升。在這一趨勢當中���,公司必須順應醫(yī)藥行業(yè)發(fā)展趨勢�,不斷加大技術(shù)投入��,才能保障公司持續(xù)具備競爭力�����。
4�����、項目實施的可行性
(1)擬實施項目有充分的數(shù)據(jù)支持
本次新藥研發(fā)項目涉及的5個品種的17個臨床研究�����,涵蓋了非小細胞肺癌、頭頸鱗癌�����、彌漫大 B 細胞淋巴瘤����、急性淋巴細胞白血病����、血管免疫母細胞性 T細胞淋巴瘤、腦膠質(zhì)瘤�、新冠病毒肺炎等適應癥。公司在選擇這些臨床研究的適應癥時�����,均充分考慮了相關(guān)疾病未滿足的臨床需求�����,并在此基礎上針對性的分析了這些品種在這些臨床需求中可能具備的優(yōu)勢和潛力�����。
公司在臨床前研究中,系統(tǒng)評價了相關(guān)品種的藥效學特征��,并進行了動物體內(nèi)試驗安全性評價�����。在參考同類藥物的國際臨床研究策略及方案的基礎上�,遵循國內(nèi)外相關(guān)指導原則,對品種本身的特點和優(yōu)勢進行綜合分析評估�,并與國內(nèi)相關(guān)領域?qū)<疫M行深入的交流及論證,可保證所制定的試驗計劃和方案的科學性與可行性���。所有擬實施的項目��,均具有充分的數(shù)據(jù)支持��。
(2)公司擁有經(jīng)驗豐富的臨床研究團隊
公司建立了一支具有豐富經(jīng)驗的臨床研究團隊����,建立了完善的臨床研究 SOP體系��,已有多項原研新藥的 I/II 期臨床試驗正在開展并按照原定計劃順利進行,臨床相關(guān)研究的質(zhì)量及時效性都具備基本的保障�,為相關(guān)臨床研究項目的完成奠定了基礎。
(3)公司已構(gòu)建科學合理的臨床開發(fā)策略
公司建立了“從臨床需求層面出發(fā)����,從科學和技術(shù)層面解決臨床需求,再到臨床中進行驗證”的科學合理的臨床開發(fā)策略�����,臨床研究總體規(guī)劃的制定均經(jīng)過公司科學家團隊與臨床專家團隊的深入探討�,在各個創(chuàng)新藥物的設計和早期研究階段即有臨床專家介入,指導從腫瘤的發(fā)病機制和臨床需求出發(fā)進行分子設計和總體研究計劃的制定�����,最大程度的保證了臨床開發(fā)策略的科學性和可行性����。
(4)擁有良好的外部資源整合能力
公司與多家國內(nèi)知名的臨床試驗合同研究組織公司建立了良好的合作關(guān)系����,與相關(guān)機構(gòu)在臨床試驗中心管理、數(shù)據(jù)管理與統(tǒng)計分析���、影像分析等方面合作良好����。公司對外部合作單位建立了嚴格的供應商審計機制,建立了相關(guān)工作流程����,可保證臨床運營的順利進行。
5���、項目基本情況
(1)SI-B001 及 SI-B003 雙特異性抗體注射液項目
①市場前景
A. 非小細胞肺癌發(fā)病情況
肺癌是我國發(fā)病率最高的惡性腫瘤����,其中非小細胞肺癌(NSCLC)約占所有肺癌患者的 85%��,我國 NSCLC 年新增發(fā)病率 48.5/10 萬人�����。從組織分類來看包括腺瘤(45.3%)���,鱗癌(43.3%)和其他(11.4%)�����。目前�����,NSCLC 用藥市場主要包括化療藥物�、靶向治療藥物、免疫療法等��?���;熕幬锍S玫挠屑魉麨I、紫杉醇和多西他賽���、鉑類藥物���、培美曲塞等,靶向藥物治療包括 EGFR-TKIs 抑制劑�����、ALK 抑制劑���、抗血管生成藥物等,免疫療法主要是 PD-1 抑制劑和 PD-L1抑制劑。
B. 結(jié)直腸癌發(fā)病情況
結(jié)直腸癌是臨床上最常見的消化系統(tǒng)惡性腫瘤�����,國家癌癥中心公布的流行病學數(shù)據(jù)顯示�,2015 年中國結(jié)直腸癌發(fā)病率 28.20/10 萬人,占全部惡性腫瘤發(fā)病的9.87%���,由結(jié)直腸癌導致的死亡病例18.71萬例��,占全部惡性腫瘤死亡的8.01%����。常用治療藥物包括 PD-1 免疫治療�����、EGFR 靶向治療或抗血管治療聯(lián)合化療等��。
C.頭頸鱗癌發(fā)病情況
頭頸部鱗狀細胞癌(HNSCC)�,是一種在解剖學及生物學上均具有異質(zhì)性的惡性腫瘤,它是一類腫瘤的統(tǒng)稱�,根據(jù)發(fā)病部位不同可以分為鼻咽癌、喉癌�、口腔癌�、口咽癌�、下咽癌等,全球發(fā)病率第六�����,我國 HNSCC 年新增發(fā)病率 15.22/10萬人���。對早期和局部晚期 HNSCC�,手術(shù)是首選的治療手段�,其次放射治療。對局部晚期不可切除的頭頸部癌��,則可選擇同步放化療��,或誘導化療+放療聯(lián)合/不聯(lián)合同步化療���。
D.作用機制和優(yōu)勢
SI-B001 可與腫瘤細胞表面的 EGFR�����、HER3 靶點同時結(jié)合�,抑制相關(guān)通路獲得 ErbB 家族信號通路抑制效果���,殺傷 EGFR 基因驅(qū)動的腫瘤細胞��。同時�����,由于其特殊的結(jié)構(gòu)特征�����,SI-B001 并不會直接與 HER3 相結(jié)合�,從而避免了分子對于維持正常生理功能靶點的抑制作用��,藥物的毒副作用低����。
SI-B003 可同時結(jié)合 T 細胞上的兩個靶點 PD-1 和 CTLA-4,阻斷靶點與其配體的結(jié)合�,從而有效地避免 T 細胞應答的起始階段和效應階段的抑制,充分調(diào)動T 細胞的活性���,產(chǎn)生協(xié)同的作用�����。SI-B001 和 SI-B003 聯(lián)用�,有望實現(xiàn)增強的協(xié)同效應,更好的殺傷腫瘤細胞�����。
E.市場和競爭情況
目前����,針對局部晚期或轉(zhuǎn)移性上皮腫瘤研發(fā)的新藥,無論是類型還是靶點���,非常豐富����。以發(fā)病率最高的肺癌為例���,單/雙抗抗體類藥物��、ADC 藥物����、小分子抑制劑藥物��,多種靶向治療、及免疫治療靶點均應用于該類腫瘤��,競爭激烈��。但另一方面����,至今沒有以 HER3 為靶點的藥物上市�����。
SI-B001 以 EGFR 和 HER3 為靶點�,有潛力解決因 HER3 上調(diào)導致的靶向治療耐藥問題,在臨床上有望超越已上市 EGFR 單抗 Cetuximab 的療效���,取得更優(yōu)的臨床療效����,解決更多的臨床未滿足需求���,形成有力的市場競爭地位�。
②項目研發(fā)進展
發(fā)行人分別于2019年11月�、2020年1月開始在中國開展SI-B001和SI-B003的劑量遞增 I 期臨床試驗�,以評價兩種新型雙特異性抗體注射液的安全性�����、耐受性和藥代動力學�����,以確定最大耐受劑量�����、劑量限制性毒性和推薦 II 期臨床研究的使用劑量����。截至本招股說明書簽署日,SI-B001 已進入 II 期臨床研究階段��,SI-B003 處于 I 期臨床研究階段��。
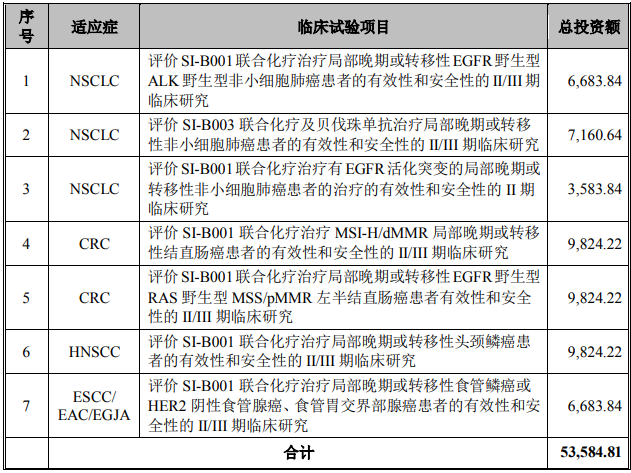
③項目投資概算
SI-B001 及 SI-B003 雙特異性抗體研發(fā)項目總投資額為 53,584.81 萬元�����,擬以募集資金 53,584.81 萬元投入臨床試驗,具體項目及投資計劃如下表所示:單位:萬元
(2)GNC-038 四特異性抗體項目
①市場前景
A.彌漫大 B 細胞淋巴瘤發(fā)病情況
彌漫大 B 細胞淋巴瘤(DLBCL)是一組大細胞�����、侵襲性的惡性淋巴瘤����,中位發(fā)病年齡 65 歲,是成人非霍奇金淋巴瘤最常見的類型��,占比約 30-40%��,亞洲國家多大于 40%����。超過一半的 DLBLC 患者可以使用標準的 R-CHOP 方案治愈����,但大約 30%至 40%的患者會發(fā)展為復發(fā)/難治性腫瘤,因而臨床上尚需要療效更佳的藥物選擇�。
B.急性淋巴細胞白血病發(fā)病情況
急性淋巴細胞白血病(ALL)是最常見的急性白血病之一���,在成人中�,約占成人急性白血病的 20%-30%;在兒童中�����,約占兒童性白血病的 80%��,是兒童最常見的惡性腫瘤���。ALL 主要起源于 B 系或 T 系淋巴祖細胞�,白血病細胞在骨髓內(nèi)異常增生和聚集并抑制正常造血���,導致貧血��、血小板減少和中性粒細胞減少���。ALL 的治療目前仍以多藥聯(lián)合化療為主,但一方面多藥聯(lián)合化療的耐受性欠佳���,另一方面�,仍有相當多數(shù)的患者面臨復發(fā)的風險�,對于 ALL 的一線治療,及復發(fā)難治 ALL 的治療�,臨床均迫需要療效和安全性更佳的治療手段。
C.濾泡型淋巴瘤發(fā)病情況
濾泡型淋巴瘤(FL)是非霍奇金淋巴瘤(NHL)中常見的類型之一,在西方國家占 NHL 患者的 22%-35%����,在中國占 NHL 患者的 8.1%-23.5%。FL 來源于生發(fā)中心的 B 細胞�,形態(tài)學表現(xiàn)為腫瘤部分保留了濾泡生長的模式,是一組包含濾泡中心細胞(小裂細胞)�����、濾泡中心母細胞(大無裂細胞)的惡性淋巴細胞增生性疾病��。
D.套細胞淋巴瘤發(fā)病情況
套細胞淋巴瘤(MCL)是一種 B 細胞淋巴瘤亞類���,占非霍奇金淋巴瘤(NHL)的 6%-8%。MCL 是起源于淋巴結(jié)套區(qū)的 B 細胞淋巴瘤�����,細胞遺傳學異常導致Cyclin D1 核內(nèi)高表達是其特征性標志����;患者以老年男性為主,結(jié)外侵犯常見��,兼具侵襲性淋巴瘤的侵襲性和惰性淋巴瘤的不可治愈性特點。
E.血管免疫母細胞性 T 細胞淋巴瘤發(fā)病情況
血管免疫母細胞性 T 細胞淋巴瘤(AITL)是一種侵襲性外周 T 細胞淋巴瘤�,在歐美是最常見的外周 T 細胞淋巴瘤(約 29%)。而亞洲相對較少�����,占外周 T細胞淋巴瘤的 15%-20%���。目前���,針對 AITL 的治療除聯(lián)合化療方案外,尚無其他有效治療手段��。
F.作用機制和優(yōu)勢
GNC-038 可同時靶向 CD3��、CD19���、PD-L1����、4-1BB 四個靶點�,通過四個腫瘤免疫治療相關(guān)蛋白結(jié)構(gòu)域(功能模塊)間的協(xié)調(diào)作用,全面���、系統(tǒng)��、深度的激活腫瘤患者的免疫系統(tǒng)��,實現(xiàn)“靶向治療+免疫治療”的雙重功能�����,最終完成針對腫瘤的靶向性��、激發(fā)型免疫攻擊���。
G.市場和競爭情況
目前���,針對 B 細胞腫瘤研發(fā)的新藥,類型和靶點均較多����。以占比最高的彌漫大 B 細胞淋巴瘤為例��,有單/雙抗抗體類藥物�����、ADC 藥物、細胞治療藥物��,多種靶向治療�����、及免疫治療靶點均應用于該類腫瘤�,競爭激烈。但另一方面����,雖然新的靶點與療法層出不窮,即使能達到很好的響應情況��,但單藥還不能實現(xiàn)淋巴瘤的治愈�,絕大多數(shù)患者不可避免地發(fā)展為復發(fā)/難治型疾病,因此藥物仍不能替代自體造血干細胞移植����。
GNC-038 以 B 細胞腫瘤成熟的、經(jīng)驗證的 CD19 為靶點����,大量的前期研究表明,該藥物有潛力達到類似 CAR-T 在患者中的響應情況���,有望實現(xiàn)自體干細胞移植的效果��,可在臨床上應用于 B 細胞腫瘤中治療中���。此外����,依靠 PD-L1 的靶向作用�����,可拓展適應癥���,解決更多的臨床未滿足需求����。
②項目研發(fā)進展
公司已于 2020 年 9 月開始在中國開展 GNC-038 的劑量遞增 Ia 期臨床試驗��,截至 2022 年 11 月 30 日���,已完成 47 例患者的給藥。GNC-038 的 Ib 期臨床試驗旨在探索 GNC-038 在復發(fā)/難治非霍奇金淋巴瘤中的療效�。
(3)GNC-039 四特異性抗體項目
①市場前景
A.腦膠質(zhì)瘤發(fā)病情況
腦膠質(zhì)瘤是由于大腦和脊髓膠質(zhì)細胞癌變所產(chǎn)生的��、最常見的原發(fā)性顱腦腫瘤�,一般是由于先天的遺傳高危因素和環(huán)境的致癌因素相互作用所導致的�。膠質(zhì)瘤的治療方式有限,現(xiàn)階段正在嘗試多種治療方法來提高膠質(zhì)母細胞瘤患者的生存期����,包括免疫治療等研究熱點,例如 CAR-T�、DC 細胞、PD-1���、PD-L1 均有針對膠質(zhì)瘤的臨床試驗��。臨床迫切需要具有突破性療效的腦膠質(zhì)瘤治療藥物����。
B.作用機制和優(yōu)勢
GNC-039 可同時靶向 CD3����、EGFRvIII、PD-L1����、4-1BB 四個靶點�,通過四個腫瘤免疫治療相關(guān)蛋白結(jié)構(gòu)域(功能模塊)間的協(xié)調(diào)作用���,全面���、系統(tǒng)、深度的激活腫瘤患者的免疫系統(tǒng)�����。GNC-039 可在外周活化效應 T 細胞及介導效應 T 細胞歸巢�,可殺傷 EGFRvIII 陽性腫瘤,抑制表達或上調(diào) PD-L1 的 EGFRvIII 陰性腫瘤的逃逸����。
C.市場和競爭情況
目前全球范圍尚無針對多形性膠質(zhì)母細胞瘤的靶向治療或免疫治療藥物上市。GNC-039 作為全球首個 EGFRvIII 靶向的四特異性抗體����,有望從機制上解決以腦膠質(zhì)瘤為例的實體瘤中的免疫抑制性和腫瘤異質(zhì)性問題,獲得突破性的藥效��,其相較于 CAR-T 具有更好的耐受性和可及性��,從而有望轉(zhuǎn)變腦膠質(zhì)瘤等實體瘤治療格局。
②項目研發(fā)進展
公司已于 2020 年 12 月獲批在中國開展 GNC-039 的 I 期臨床試驗���。截至2022 年 11 月 30 日,已完成 22 例患者的給藥�����,旨在探索 GNC-039 臨床用藥的安全性���,指導后續(xù)用藥方案的制定���。
(4)SI-F019 融合蛋白項目
①市場前景
A.新冠肺炎發(fā)病情況
新型冠狀病毒肺炎(新冠肺炎,COVID-19)為新發(fā)急性呼吸道傳染病�,目前已成為全球性重大的公共衛(wèi)生事件。截止到 2021 年 9 月 30 日��,全球累計共有23,390.87 萬例 COVID-19 病例�,累計死亡病例 477.75 萬例,全球患病及死亡人數(shù)仍呈上升趨勢�。通過積極防控和救治,我國境內(nèi)疫情基本得到控制�,僅在個別地區(qū)出現(xiàn)局部暴發(fā)和少數(shù)境外輸入病例。由于全球疫情仍在蔓延��,且有可能較長時期存在,新冠肺炎在我國傳播和擴散的風險也將持續(xù)存在����。
B.作用機制和優(yōu)勢
新冠病毒感染人體細胞的受體為 ACE2,以 ACE2 為靶點所研發(fā)的疫苗類藥物��、中和抗體類藥物是當前新冠肺炎疫情防治的重要武器 �����。 SI-F019 為雙價ACE2-Fc(n2)融合蛋白�,可通過高親和力競爭性結(jié)合新冠病毒衣殼上的 S 蛋白,阻斷病毒感染人體細胞��。同時可將血管緊張素 II(Ang-II)水解為 Ang1-7�,調(diào)控血壓,減輕急性呼吸窘迫癥狀����。同時,還有望解決現(xiàn)有防治手段存在的突變耐藥問題�����,并可避免 ADE 效應�����。
C.市場和競爭情況
根據(jù)國家衛(wèi)健委最新發(fā)布的《新型冠狀病毒肺炎診療方案》(試行第八版),除一般性的對癥�,及針對危重癥病人的支持治療外,治療策略主要包括抗病毒治療��、免疫治療����、糖皮質(zhì)激素治療等�����,預防措施最直接的手段為接種新型冠狀病毒疫苗����,我國第一款新冠滅活疫苗已于 2020 年 12 月獲得國家藥監(jiān)局批準附條件上市。截至 2020 年 12 月 31 日���,國家藥監(jiān)局批準國藥集團中國生物新冠滅活疫苗附條件上市�,海外有 3 款新冠疫苗分別來自輝瑞����、Moderna 和阿斯利康,已獲批上市。
此外�����,中和抗體類藥物因其對新冠病毒的特異性作用而備受矚目����。中和抗體具備阻斷病毒侵染目的細胞的潛力,在新型冠狀病毒(以下簡稱新冠病毒)肺炎患者治療過程中��,康復期病人血漿治療取得了較好的療效���,顯示出中和抗體在新冠病毒肺炎治療方面的潛力����。單克隆抗體�、融合蛋白類具備病毒中和能力的藥物,具有作用機制明確�����、易于大規(guī)模生產(chǎn)的優(yōu)點�,是新冠病毒治療藥物研究的重點方向。
②項目研發(fā)進展
SI-F019 已完成 I 期臨床研究�����,已完成 36 例患者的給藥,正在評價產(chǎn)品在臨床中的安全性����、耐受性和藥代動力學特征?��;?SI-F019 的作用機制及當前新冠病毒肺炎(COVID-19)疫情的背景,SI-F019 計劃優(yōu)先開發(fā) COVID-19 的治療���,在新冠病毒肺炎患者中開展在常規(guī)治療基礎上���,與安慰劑對比的隨機對照臨床研究。
6����、項目備案情況
2021 年 9 月 13 日,“腫瘤治療領域創(chuàng)新抗體類藥物研發(fā)項目”項目取得成都市溫江區(qū)經(jīng)濟和信息化局出具的《四川省技術(shù)改造投資項目備案表》(備案號:川投資備【2109-510115-07-02-605690】JXQB-0392 號)��。
2021 年 8 月 31 日�,“新冠治療領域創(chuàng)新抗體類藥物研發(fā)項目”項目取得成都市溫江區(qū)經(jīng)濟和信息化局出具的《四川省技術(shù)改造投資項目備案表》(備案號:川投資備【2108-510115-07-02-440102】JXQB-0375 號)。
此報告為正式報告摘取部分��。需編制政府立項、銀行貸款�����、投資決策等用途可行性研究報告咨詢思瀚產(chǎn)業(yè)研究院����。
免責聲明:
1.本站部分文章為轉(zhuǎn)載,其目的在于傳播更多信息�����,我們不對其準確性�����、完整性����、及時性、有效性和適用性等任何的陳述和保證�����。本文僅代表作者本人觀點����,并不代表本網(wǎng)贊同其觀點和對其真實性負責�。
2.思瀚研究院一貫高度重視知識產(chǎn)權(quán)保護并遵守中國各項知識產(chǎn)權(quán)法律���。如涉及文章內(nèi)容�、版權(quán)等問題��,我們將及時溝通與處理�。









 美國亞利桑那州-記憶綿床墊生產(chǎn)基地擴建項目可行性研究報告
美國亞利桑那州-記憶綿床墊生產(chǎn)基地擴建項目可行性研究報告 江西宜春-高能量密度動力儲能(方形)鋰電池研發(fā)產(chǎn)業(yè)化項目可行性研究報告
江西宜春-高能量密度動力儲能(方形)鋰電池研發(fā)產(chǎn)業(yè)化項目可行性研究報告 水晶光電-臺州智能終端用光學組件技改項目可行性研究報告
水晶光電-臺州智能終端用光學組件技改項目可行性研究報告 廣西欽州-中偉股份北部灣產(chǎn)業(yè)基地三元項目一期可行性研究報告
廣西欽州-中偉股份北部灣產(chǎn)業(yè)基地三元項目一期可行性研究報告 中國天津-毫米波雷達研發(fā)中心建設項目可行性研究報告
中國天津-毫米波雷達研發(fā)中心建設項目可行性研究報告 中國重慶-國儲珞璜智慧物流園項目可行性研究報告
中國重慶-國儲珞璜智慧物流園項目可行性研究報告 安徽合肥-高性能微電子級聚酰亞胺膜材料項目可行性研究報告
安徽合肥-高性能微電子級聚酰亞胺膜材料項目可行性研究報告 廣東汕頭-生殖健康藥品整體升級項目可行性研究報告
廣東汕頭-生殖健康藥品整體升級項目可行性研究報告