創(chuàng)新藥物臨床���、許可引進(jìn)及產(chǎn)品上市相關(guān)準(zhǔn)備可行性研究報(bào)告
2021-05-20
創(chuàng)新藥物臨床��、許可引進(jìn)及產(chǎn)品上市相關(guān)準(zhǔn)備
1��、項(xiàng)目簡介
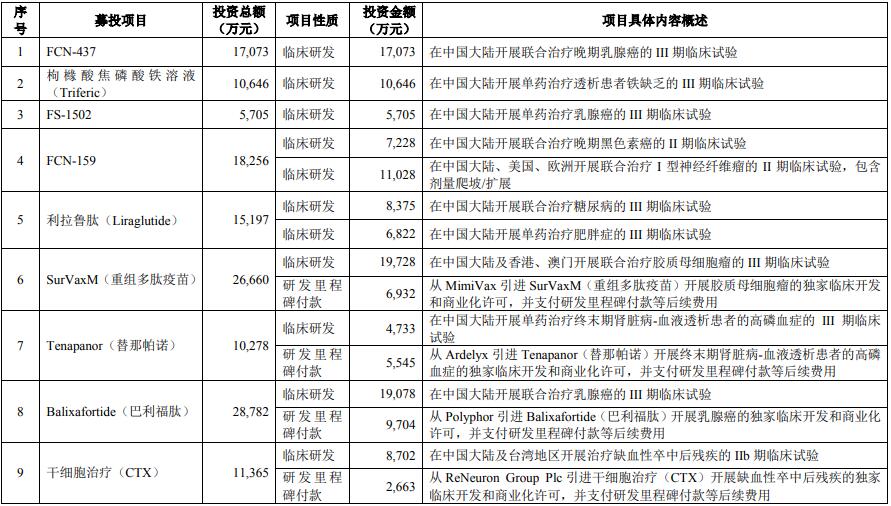
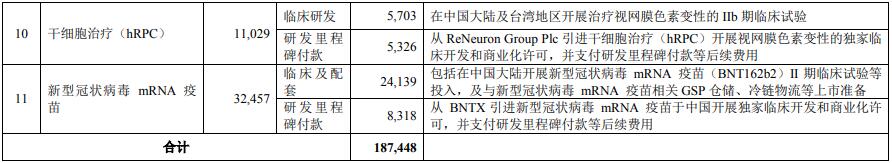
項(xiàng)目總投資 187,448 萬元用于創(chuàng)新藥物的臨床開發(fā)、商業(yè)化許可���、許可引進(jìn)項(xiàng)目研發(fā)里程碑支付及部分產(chǎn)品上市準(zhǔn)備相關(guān)等后續(xù)費(fèi)用���。項(xiàng)目擬推進(jìn)FCN-437、枸櫞酸焦磷酸鐵溶液(Triferic)���、FS-1502����、FCN-159 �����、利拉魯肽(Liraglutide)��、SurVaxM(重組多肽疫苗)����、 Tenapanor(替那帕諾1)、Balixafortide(巴利福肽2)��、干細(xì)胞治療(CTX)��、干細(xì)胞治療(hRPC)、新型冠狀病毒 mRNA疫苗等的臨床進(jìn)展及部分項(xiàng)目的上市準(zhǔn)備工作��,并就 SurVaxM(重組多肽疫苗)�����、Tenapanor(替那帕諾)�、Balixafortide(巴利福肽)、干細(xì)胞療法(CTX 及 hRPC)�����、新型冠狀病毒 mRNA 疫苗的臨床進(jìn)展向?qū)?yīng)授權(quán)許可方支付里程碑付款等后續(xù)費(fèi)用���。本項(xiàng)目涉及的許可引進(jìn)項(xiàng)目均已完成相應(yīng)的授權(quán)許可協(xié)議簽署。
以 Balixafortide(巴利福肽)為例����,2020 年 8 月,本集團(tuán)與瑞士生物技術(shù)公司 Polyphor Ltd(以下簡稱“Polyphor”)簽訂了 CXCR4 拮抗劑 Balixafortide 獨(dú)家許可協(xié)議�。Balixafortide 是一款 CXCR4 強(qiáng)效高選擇性拮抗劑,CXCR4 對(duì)腫瘤的生長�����、侵襲、血管生成����、轉(zhuǎn)移和對(duì)治療藥物的耐藥性起著重要作用。美國 FDA已于 2018 年授予該藥物快速通道地位�,用于與 eribulin 聯(lián)合治療此前已至少接受了兩次化療方案的 HER2 陰性轉(zhuǎn)移性乳腺癌患者。
目前 Polyphor 正在就Balixafortide 進(jìn)行一項(xiàng)隨機(jī)陽性對(duì)照���、開放的全球多中心臨床Ⅲ期研究�����。作為Polyphor 的合作伙伴���,本集團(tuán)將與其共同在中國開發(fā)和商業(yè)化 Balixafortide。此外據(jù)相關(guān)臨床前模型顯示�,CXCR4 拮抗劑可以增強(qiáng)不同抗癌療法的活性,具有與其他多種藥物在不同實(shí)體瘤適應(yīng)癥的聯(lián)合治療方案的巨大潛力����,此次合作不僅豐富本集團(tuán)在抗腫瘤治療領(lǐng)域的產(chǎn)品線,同時(shí)也能夠?yàn)槭袌?chǎng)尚未滿足的臨床需求提供更多的治療選擇����。
關(guān)于新型冠狀病毒 mRNA 疫苗����,當(dāng)前新冠肺炎在全球大流行�����,截至 2021 年3 月 22 日���,全球新冠肺炎現(xiàn)存確診人數(shù)已超過 2,500 萬��,累計(jì)死亡人數(shù)已超過270 萬�。新冠肺炎疫情的爆發(fā)不但嚴(yán)重沖擊全球經(jīng)濟(jì)政治秩序�,也對(duì)我國常態(tài)化的疫情防控造成了巨大挑戰(zhàn)。具有科學(xué)有效預(yù)防效力和安全性的新型冠狀病毒疫苗具有重大臨床需求����。2020 年 3 月��,本集團(tuán)獲得 BNTX 授權(quán)����,在中國大陸及港澳臺(tái)地區(qū)獨(dú)家開發(fā)、商業(yè)化基于其專有的 mRNA 技術(shù)平臺(tái)研發(fā)的����、針對(duì)預(yù)防新冠肺炎的疫苗產(chǎn)品���。2020 年 11 月 13 日,本集團(tuán)收到國家藥品監(jiān)督管理局(以下簡稱“國家藥監(jiān)局”)關(guān)于本集團(tuán)獲許可的新型冠狀病毒 mRNA 疫苗 BNT162b2用于預(yù)防新型冠狀病毒肺炎的臨床試驗(yàn)批準(zhǔn)�。
2021 年 1 月,該疫苗已于中國香港獲認(rèn)可作緊急使用�����,并已于 2021 年 3 月被分別使用于中國香港�、中國澳門的政府接種計(jì)劃。截至本可行性分析報(bào)告公告之日���,該疫苗在中國內(nèi)地的 II 期臨床試驗(yàn)也在有序推進(jìn)中��。本次非公開發(fā)行募集資金將幫助本集團(tuán)加快推進(jìn)該疫苗于中國大陸的 II 期臨床試驗(yàn)�,及 GSP 倉儲(chǔ)����、冷鏈物流等上市相關(guān)準(zhǔn)備工作,有利于保障人民生命健康和生產(chǎn)生活秩序穩(wěn)定���。
本項(xiàng)目的實(shí)施���,是繼續(xù)推進(jìn)本集團(tuán)創(chuàng)新發(fā)展戰(zhàn)略的又一舉措��,通過自主研發(fā)����、合作開發(fā)�、許可引進(jìn)、深度孵化等多元化�����、多層次的合作模式�����,有利于提升本集團(tuán)的研發(fā)效率����,快速豐富產(chǎn)品線,降低研發(fā)風(fēng)險(xiǎn)�����,滿足重大臨床需求��,增強(qiáng)本集團(tuán)產(chǎn)品線的市場(chǎng)競(jìng)爭力�����,進(jìn)一步夯實(shí)本集團(tuán)的整體競(jìng)爭優(yōu)勢(shì)����。
2、項(xiàng)目投資概算
本項(xiàng)目對(duì)應(yīng)的投資概算如下:
注:上述各研發(fā)項(xiàng)目和研發(fā)項(xiàng)目內(nèi)不同適應(yīng)癥之間的投入可根據(jù)本集團(tuán)臨床研究進(jìn)展和實(shí)際情況所需進(jìn)行適當(dāng)調(diào)整����。
3、項(xiàng)目建設(shè)必要性
(1)政策利好�����,順應(yīng)創(chuàng)新藥行業(yè)發(fā)展趨勢(shì)
近年來�,中國出臺(tái)了多項(xiàng)政策來促進(jìn)中國創(chuàng)新藥產(chǎn)業(yè)的發(fā)展?����!端幤纷?cè)管理辦法》從分類的重新定義可見��,中國藥品注冊(cè)管理的關(guān)注點(diǎn)正在向創(chuàng)新藥傾斜?����!杜R床急需藥品附條件批準(zhǔn)上市技術(shù)指導(dǎo)原則》���、《突破性治療藥物工作程序》�、《優(yōu)先審評(píng)審批工作程序》���、《關(guān)于鼓勵(lì)藥品創(chuàng)新實(shí)行優(yōu)先審評(píng)審批的意見》等文件的出臺(tái)為創(chuàng)新藥審批效率的提升提供了政策支持�。
此外�,針對(duì)仿制藥出臺(tái)的一系列政策,例如 2018 年 4 月國務(wù)院發(fā)布的《關(guān)于改革完善仿制藥供應(yīng)保障及使用政策的意見》及 2019 年 6 月國家衛(wèi)生健康委員會(huì)(以下簡稱“國家衛(wèi)健委” )發(fā)布的《第一批鼓勵(lì)仿制藥品目錄建議清單》�����,明確促進(jìn)有臨床需求/科學(xué)依據(jù)的仿制藥的發(fā)展���,亦在一定程度上鼓勵(lì)了真正具有創(chuàng)新價(jià)值的藥品研發(fā)�����。2020 年�����,與《藥品管理法》相配套的《藥品注冊(cè)管理辦法》����、《藥品生產(chǎn)監(jiān)督管理辦法》等規(guī)范先后發(fā)布�����,完善上市許可持有人(MAH)主體責(zé)任及相關(guān)制度�����,修訂完善化學(xué)藥��、生物藥����、中成藥等的各項(xiàng)研發(fā)技術(shù)規(guī)范及注冊(cè)管理,繼續(xù)改革優(yōu)化審評(píng)審批制度及生產(chǎn)管理等內(nèi)容�,支持以臨床價(jià)值為導(dǎo)向的藥物創(chuàng)新。
創(chuàng)新藥的研發(fā)是推動(dòng)醫(yī)藥企業(yè)發(fā)展的重要?jiǎng)恿?��,也是現(xiàn)階段中國重點(diǎn)支持的領(lǐng)域��,政策的大力支持使得中國創(chuàng)新藥市場(chǎng)將進(jìn)入快速發(fā)展通道����。隨著中國醫(yī)藥行業(yè)的不斷發(fā)展以及創(chuàng)新藥、集中采購等政策的影響���,制藥企業(yè)的業(yè)務(wù)重心逐步從過去的仿制藥向創(chuàng)新藥轉(zhuǎn)型��,尤其是行業(yè)內(nèi)規(guī)模較大的醫(yī)藥公司����,正逐漸加大創(chuàng)新藥的研發(fā)投入���,以維持其在醫(yī)藥行業(yè)的市場(chǎng)地位�����。在此背景下�,本集團(tuán)有必要加大創(chuàng)新藥的研發(fā)力度����,鞏固本集團(tuán)在業(yè)內(nèi)的競(jìng)爭優(yōu)勢(shì),提升企業(yè)的核心競(jìng)爭力�����。
(2)開拓創(chuàng)新藥研發(fā),解決臨床需求
本項(xiàng)目中的產(chǎn)品涉及惡性腫瘤�、代謝性疾病、消化系統(tǒng)疾病�、預(yù)防新冠肺炎等適應(yīng)癥領(lǐng)域���,屬于市場(chǎng)臨床需求大�����、成穩(wěn)定增長趨勢(shì)的病癥��,本項(xiàng)目的推進(jìn)能夠?yàn)榛颊邘硇碌闹委熂邦A(yù)防手段��,改善患者用藥需求�����。本項(xiàng)目的實(shí)施有助于加快相關(guān)品種在國內(nèi)的研發(fā)及產(chǎn)業(yè)化進(jìn)程����,滿足重大臨床需求���,本集團(tuán)在抗相關(guān)領(lǐng)域已積累多年的研發(fā)經(jīng)驗(yàn)�,并擁有多款產(chǎn)品已經(jīng)上市,本項(xiàng)目的實(shí)施有利于增強(qiáng)本集團(tuán)相關(guān)產(chǎn)品線的市場(chǎng)競(jìng)爭力����。
(3)完善自主研發(fā)、合作開發(fā)���、許可引進(jìn)��、深度孵化的研發(fā)體系���,加速創(chuàng)新轉(zhuǎn)型和產(chǎn)品迭代
本集團(tuán)依托自有的全球資源網(wǎng)絡(luò)和國際研發(fā)平臺(tái),打造開放式創(chuàng)新研發(fā)生態(tài)���,通過自主研發(fā)��、合作開發(fā)���、許可引進(jìn)、深度孵化不斷擴(kuò)充產(chǎn)品線�����,同時(shí)依托多年根植產(chǎn)業(yè)所累積的臨床注冊(cè)、市場(chǎng)準(zhǔn)入及學(xué)術(shù)推廣能力�,有效實(shí)現(xiàn)創(chuàng)新品種落地及商業(yè)化,從而建立高效�、可持續(xù)的創(chuàng)新研發(fā)體系。
本次非公開發(fā)行募集資金投入到臨床試驗(yàn)及里程碑支付當(dāng)中���,將加快本集團(tuán)創(chuàng)新轉(zhuǎn)型和產(chǎn)品迭代的進(jìn)程�����,不斷完善本集團(tuán)的開放式研發(fā)生態(tài),強(qiáng)化本集團(tuán)核心競(jìng)爭力�,確保本集團(tuán)業(yè)績的長期增長。
4�����、項(xiàng)目投資可行性
(1)醫(yī)藥產(chǎn)業(yè)政策的支持
創(chuàng)新研發(fā)是醫(yī)藥產(chǎn)業(yè)發(fā)展動(dòng)力��,政策支持鼓勵(lì)和保障是關(guān)鍵�。在藥物研發(fā)方面,國務(wù)院和相關(guān)部委先后發(fā)布了《罕見病診療指南(2019 年版)》���、《第一批鼓勵(lì)仿制藥品目錄》�、《第三批鼓勵(lì)研發(fā)申報(bào)兒童藥品清單》、《第二批臨床急需境外新藥名單》��,為藥品創(chuàng)新研發(fā)指出品種方向�����。中國在創(chuàng)新支持方面圍繞“科技重大專項(xiàng)”也提前開展布局����,國家衛(wèi)健委科教司先后印發(fā)《關(guān)于組織重大新藥創(chuàng)制科技重大專項(xiàng) 2020 年度課題申報(bào)的通知》、《衛(wèi)生健康“十四五”規(guī)劃前期研究重大課題征集公告》�����、《科技重大專項(xiàng)相關(guān)工作規(guī)則及管理辦法的通知》等政策文件�����,進(jìn)一步優(yōu)化完善政府支持鼓勵(lì)醫(yī)藥創(chuàng)新的機(jī)制和舉措���。中國醫(yī)藥產(chǎn)業(yè)政策的支持為本項(xiàng)目的實(shí)施提供了良好的政策保障����。
(2)持續(xù)研發(fā)創(chuàng)新
本集團(tuán)以制藥為核心,堅(jiān)持并不斷優(yōu)化發(fā)展戰(zhàn)略���,在做好現(xiàn)有業(yè)務(wù)及產(chǎn)業(yè)升級(jí)的基礎(chǔ)上�����,專注投入在療效確切��、符合現(xiàn)代醫(yī)學(xué)發(fā)展導(dǎo)向的領(lǐng)域�����,堅(jiān)持提升早期研發(fā)和后期產(chǎn)業(yè)化開發(fā)能力�����,不斷加大研發(fā)投入,2020 年度本集團(tuán)研發(fā)投入共計(jì) 40.03 億元�����,較 2019 年度增長 15.59%��。
目前�,本集團(tuán)已形成了國際化的研發(fā)布局,具備較強(qiáng)的研發(fā)能力,在中國����、美國、印度等建立了互動(dòng)一體化的研發(fā)體系并打造小分子創(chuàng)新藥�����、抗體藥物��、細(xì)胞治療等國際研發(fā)平臺(tái)�����,此外�����,秉承開放合作���,還通過自主研發(fā)�����、合作開發(fā)����、許可引進(jìn)、深度孵化等多元化���、多層次的合作模式對(duì)接全球優(yōu)秀科學(xué)家團(tuán)隊(duì)���、領(lǐng)先技術(shù)及高價(jià)值產(chǎn)品,推動(dòng)創(chuàng)新技術(shù)和產(chǎn)品在全球的開發(fā)和轉(zhuǎn)化落地�����。本集團(tuán)持續(xù)的研發(fā)創(chuàng)新為本項(xiàng)目的實(shí)施奠定了堅(jiān)實(shí)的基礎(chǔ)�。
(3)雄厚的技術(shù)儲(chǔ)備及強(qiáng)大的研發(fā)實(shí)力
本集團(tuán)以創(chuàng)新研發(fā)為核心驅(qū)動(dòng)因素,通過自主研發(fā)�、合作開發(fā)、許可引進(jìn)����、深度孵化的方式���,布局國際化高水平并具有成本優(yōu)勢(shì)的研發(fā)及制造體系��,通過多層次創(chuàng)新����,持續(xù)優(yōu)化產(chǎn)品結(jié)構(gòu),完善產(chǎn)品布局�,加快推進(jìn)一線治療藥物的上市。
截至 2020 年 12 月 31 日���,本集團(tuán)主要在研新藥��、仿制藥����、生物類似藥及仿制藥一致性評(píng)價(jià)等項(xiàng)目 247 項(xiàng)�����,制藥板塊專利申請(qǐng)達(dá) 176 項(xiàng)����,其中包括美國專利申請(qǐng)12 項(xiàng)、PCT 申請(qǐng) 16 項(xiàng)�����,獲得發(fā)明專利授權(quán) 70 項(xiàng)����。通過持續(xù)的研發(fā)創(chuàng)新�����,本集團(tuán)形成了雄厚的技術(shù)儲(chǔ)備����,為本項(xiàng)目的順利實(shí)施提供了有力支持����。
醫(yī)藥的研發(fā)創(chuàng)新需要專業(yè)的研發(fā)團(tuán)隊(duì),人才是本集團(tuán)求生存���、謀發(fā)展的關(guān)鍵因素����,本集團(tuán)高度重視高素質(zhì)研發(fā)人才的外部引進(jìn)與自主培養(yǎng)�����,經(jīng)過多年的發(fā)展�,建立了一支專業(yè)素質(zhì)過硬�、年齡結(jié)構(gòu)合理��、行業(yè)經(jīng)驗(yàn)豐富的研發(fā)團(tuán)隊(duì)��,截至 2020年年末�����,本集團(tuán)擁有研發(fā)人員近 2,300 人�,在小分子創(chuàng)新藥����、抗體藥物、細(xì)胞治療等領(lǐng)域擁有豐富的研發(fā)經(jīng)驗(yàn)�,能夠?yàn)橐M(jìn)項(xiàng)目的后續(xù)研發(fā)和順利產(chǎn)業(yè)化提供有力支持。
(4)與合作方協(xié)作良好�����,已具備成熟的產(chǎn)品臨床注冊(cè)能力
在自主研發(fā)�����、合作開發(fā)�����、許可引進(jìn)、深度孵化的研發(fā)體系下�,本集團(tuán)通過多年深耕,與各合作方均協(xié)作良好�����,已經(jīng)具備了成熟的與合作方共同開發(fā)產(chǎn)品���、推進(jìn)臨床進(jìn)展�、藥品注冊(cè)上市等全流程合作的能力�����。
以馬來酸阿伐曲泊帕片為例�,本集團(tuán)于 2018 年 3 月獲美國 AkaRx Inc.關(guān)于該產(chǎn)品在中國大陸及香港特別行政區(qū)的獨(dú)家銷售代理權(quán)的許可,并于 2020 年 4月收到國家藥監(jiān)局關(guān)于馬來酸阿伐曲泊帕片的《進(jìn)口藥品注冊(cè)證》���,批準(zhǔn)該新藥適用于擇期行診斷性操作或者手術(shù)的慢性肝病相關(guān)血小板減少癥的成年患者���。
就本次非公開發(fā)行募投項(xiàng)目而言,以新型冠狀病毒 mRNA 疫苗為例�,2020年 3 月,本集團(tuán)獲得 BNTX 授權(quán)����,在中國大陸及港澳臺(tái)地區(qū)獨(dú)家開發(fā)、商業(yè)化基于其專有的 mRNA 技術(shù)平臺(tái)研發(fā)的����、針對(duì)預(yù)防新冠肺炎的疫苗產(chǎn)品。在此基礎(chǔ)上����,本集團(tuán)積極開展了候選疫苗產(chǎn)品的臨床推進(jìn)工作,就 BNT162b1 于 2020年 7 月獲國家藥監(jiān)局臨床試驗(yàn)批準(zhǔn)�,截至本可行性分析報(bào)告公告之日,已完成 I期臨床受試者接種程序�����,現(xiàn)處于數(shù)據(jù)統(tǒng)計(jì)分析過程中���。BNT162b1 的研發(fā)使本集團(tuán)積累了疫苗臨床試驗(yàn)的經(jīng)驗(yàn)和團(tuán)隊(duì)��,為開展 BNT162b2 研發(fā)奠定了良好的基礎(chǔ)����。
于 2020 年 11 月 13 日��,本集團(tuán)獲得了國家藥監(jiān)局關(guān)于同意 BNT162b2 用于預(yù)防新冠肺炎的臨床試驗(yàn)批準(zhǔn)。2021 年 1 月����,該疫苗已于中國香港獲認(rèn)可作緊急使用,并已于 2021 年 3 月被分別使用于中國香港���、中國澳門的政府接種計(jì)劃���。截至本可行性分析報(bào)告公告之日,該疫苗在中國內(nèi)地的 II 期臨床試驗(yàn)也在有序推進(jìn)中�。
(5)強(qiáng)大的商業(yè)化能力
截至 2020 年 12 月 31 日,本集團(tuán)持續(xù)強(qiáng)化營銷體系的建設(shè)與整合����,已形成與現(xiàn)有產(chǎn)品及擬上市產(chǎn)品相配套的分線營銷體系,并秉承專業(yè)化���、品牌化及數(shù)字化的戰(zhàn)略方向��。截至 2020 年 12 月 31 日�����,本集團(tuán)商業(yè)化團(tuán)隊(duì)近 6,000 人��,圍繞主要產(chǎn)品線劃分為多個(gè)事業(yè)部����,覆蓋超過 2,000 家三級(jí)醫(yī)院,10,000 家一�����、二級(jí)醫(yī)院���。尤其在近兩年,為了配合創(chuàng)新產(chǎn)品的上市及國際化進(jìn)程���,本集團(tuán)著重打造了創(chuàng)新藥商業(yè)化團(tuán)隊(duì)�、OTC 及線上渠道的新零售團(tuán)隊(duì)����、非洲及歐美商業(yè)化團(tuán)隊(duì),并且在醫(yī)學(xué)事務(wù)��、市場(chǎng)準(zhǔn)入����、品牌推廣等方面構(gòu)建及完善了全方位的支持體系�����。
5����、項(xiàng)目實(shí)施主體
本項(xiàng)目的實(shí)施主體包括本公司全資子公司上海復(fù)星醫(yī)藥產(chǎn)業(yè)發(fā)展有限公司�、江蘇萬邦生化醫(yī)藥集團(tuán)有限責(zé)任公司、錦州奧鴻藥業(yè)有限責(zé)任公司和 FosunPharmaceuticalAG��。
6�����、項(xiàng)目涉及報(bào)批事項(xiàng)情況
本集團(tuán)將積極推進(jìn)本項(xiàng)目涉及的相關(guān)報(bào)批事項(xiàng)�。
免責(zé)聲明:
1.本站部分文章為轉(zhuǎn)載,其目的在于傳播更多信息���,我們不對(duì)其準(zhǔn)確性����、完整性����、及時(shí)性�、有效性和適用性等任何的陳述和保證�。本文僅代表作者本人觀點(diǎn),并不代表本網(wǎng)贊同其觀點(diǎn)和對(duì)其真實(shí)性負(fù)責(zé)�。
2.思瀚研究院一貫高度重視知識(shí)產(chǎn)權(quán)保護(hù)并遵守中國各項(xiàng)知識(shí)產(chǎn)權(quán)法律。如涉及文章內(nèi)容�����、版權(quán)等問題���,我們將及時(shí)溝通與處理。









 美國亞利桑那州-記憶綿床墊生產(chǎn)基地?cái)U(kuò)建項(xiàng)目可行性研究報(bào)告
美國亞利桑那州-記憶綿床墊生產(chǎn)基地?cái)U(kuò)建項(xiàng)目可行性研究報(bào)告 江西宜春-高能量密度動(dòng)力儲(chǔ)能(方形)鋰電池研發(fā)產(chǎn)業(yè)化項(xiàng)目可行性研究報(bào)告
江西宜春-高能量密度動(dòng)力儲(chǔ)能(方形)鋰電池研發(fā)產(chǎn)業(yè)化項(xiàng)目可行性研究報(bào)告 水晶光電-臺(tái)州智能終端用光學(xué)組件技改項(xiàng)目可行性研究報(bào)告
水晶光電-臺(tái)州智能終端用光學(xué)組件技改項(xiàng)目可行性研究報(bào)告 廣西欽州-中偉股份北部灣產(chǎn)業(yè)基地三元項(xiàng)目一期可行性研究報(bào)告
廣西欽州-中偉股份北部灣產(chǎn)業(yè)基地三元項(xiàng)目一期可行性研究報(bào)告 中國天津-毫米波雷達(dá)研發(fā)中心建設(shè)項(xiàng)目可行性研究報(bào)告
中國天津-毫米波雷達(dá)研發(fā)中心建設(shè)項(xiàng)目可行性研究報(bào)告 中國重慶-國儲(chǔ)珞璜智慧物流園項(xiàng)目可行性研究報(bào)告
中國重慶-國儲(chǔ)珞璜智慧物流園項(xiàng)目可行性研究報(bào)告 安徽合肥-高性能微電子級(jí)聚酰亞胺膜材料項(xiàng)目可行性研究報(bào)告
安徽合肥-高性能微電子級(jí)聚酰亞胺膜材料項(xiàng)目可行性研究報(bào)告 廣東汕頭-生殖健康藥品整體升級(jí)項(xiàng)目可行性研究報(bào)告
廣東汕頭-生殖健康藥品整體升級(jí)項(xiàng)目可行性研究報(bào)告