醫(yī)藥政策鼓勵(lì)由仿制藥向創(chuàng)新藥發(fā)展��,推動(dòng)國(guó)內(nèi) CRO 市場(chǎng)擴(kuò)張
思瀚產(chǎn)業(yè)研究院 2022-06-13
醫(yī)藥行業(yè)具有較強(qiáng)的政策導(dǎo)向性特點(diǎn),早期國(guó)內(nèi)醫(yī)藥市場(chǎng)主要以仿制藥為主��,創(chuàng)新藥研發(fā)動(dòng)力不足�,CRO 市場(chǎng)需求度相對(duì)較低�。近年來(lái),國(guó)家層面出臺(tái)的系列政策促進(jìn)國(guó)內(nèi)創(chuàng)新藥研發(fā)����,推動(dòng)醫(yī)藥產(chǎn)業(yè)實(shí)現(xiàn)由仿制為主向自主創(chuàng)新為主的升級(jí)轉(zhuǎn)變��。
在國(guó)務(wù)院《關(guān)于改革藥品醫(yī)療器械審評(píng)審批制度的意見》(國(guó)發(fā)[2015]44號(hào))及中共中央辦公廳、國(guó)務(wù)院辦公廳《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》(廳字[2017]42 號(hào))的政策出臺(tái)后���,國(guó)家藥品監(jiān)督管理局在鼓勵(lì)藥物研發(fā)創(chuàng)新�、提高藥品質(zhì)量方面不斷推進(jìn)審評(píng)審批制度改革�,為創(chuàng)新藥研發(fā)提供良好的政策環(huán)境。2018 年 7 月���,NMPA 出臺(tái)政策提出在我國(guó)申報(bào)藥物臨床試驗(yàn)的��,自申請(qǐng)受理起 60 日內(nèi)��,申請(qǐng)人未收到國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心(CDE)否定或質(zhì)疑意見的����,可按照提交的方案開展藥物臨床試驗(yàn)�����,進(jìn)一步促進(jìn)新藥開發(fā)��。
藥品上市許可持有人制度(MAH)于 2015 年起推出后����,極大地促進(jìn)我國(guó)醫(yī)藥行業(yè)的技術(shù)創(chuàng)新和質(zhì)量體系的提高��。對(duì)于研發(fā)機(jī)構(gòu)來(lái)說(shuō)���,在 MAH 制度下可以作為上市許可持有人持有藥品批準(zhǔn)文號(hào),分別委托藥品生產(chǎn)企業(yè)進(jìn)行生產(chǎn)和銷售企業(yè)進(jìn)行銷售���,從而獲得直接收益�����,增強(qiáng)企業(yè)研發(fā)動(dòng)力�����,驅(qū)動(dòng)研發(fā)人員創(chuàng)新積極性�。此外��,在 MAH 制度下��,如果不含技術(shù)審評(píng)時(shí)間��,新藥臨床申報(bào)可由之前的
117-127 天縮短至 14 天���;若包含技術(shù)審評(píng)時(shí)間���,則由原先的 12-18 個(gè)月縮短至9.5 個(gè)月,大幅度加速了新藥的上市進(jìn)程���。在這個(gè)大環(huán)境下���,研發(fā)機(jī)構(gòu)需要建立完整合理的質(zhì)量管理體系和藥品安全監(jiān)測(cè)體系,積極采取開放式合作模式����,同CRO 研究機(jī)構(gòu)積極合作降低新藥研發(fā)成本和分散風(fēng)險(xiǎn)。
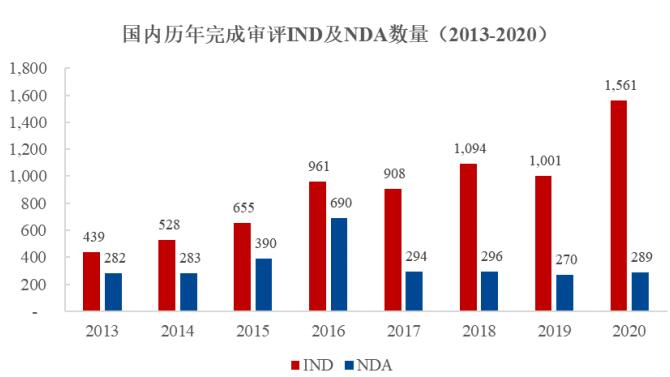
根據(jù)國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心(CDE)公布的數(shù)據(jù)���,2015年以來(lái)國(guó)內(nèi)完成審評(píng)的 IND 數(shù)量大幅增長(zhǎng)�。根據(jù)國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心(CDE)發(fā)布的 2020 年度藥品審評(píng)報(bào)告�����,藥審中心 2020 年度完成 IND 申請(qǐng)審評(píng) 1,561 件�����,較 2019 年增長(zhǎng) 55.94%;審評(píng)通過(guò)批準(zhǔn) IND 申請(qǐng) 1,435 件�����,較 2019年增長(zhǎng) 54.97%����;審評(píng)通過(guò) NDA208 件,較 2019 年增長(zhǎng) 26.83%��。
資料來(lái)源:國(guó)家藥品監(jiān)督管理局歷年《藥品審評(píng)報(bào)告》
受益于我國(guó)醫(yī)藥行業(yè)的高速發(fā)展�����,我國(guó) CRO 行業(yè)的市場(chǎng)規(guī)模亦逐年擴(kuò)大����。根據(jù) Frost & Sullivan 的數(shù)據(jù)統(tǒng)計(jì),2015 年至 2024 年�,我國(guó) CRO 市場(chǎng)規(guī)模將從26 億美元增長(zhǎng)到 221 億美元,預(yù)計(jì)年均復(fù)合增長(zhǎng)率為 26.84%����。未來(lái)隨著國(guó)內(nèi)對(duì)創(chuàng)新藥研發(fā)的需求加速釋放,CRO 行業(yè)將迎來(lái)持續(xù)增長(zhǎng)的行業(yè)發(fā)展黃金機(jī)遇��。
免責(zé)聲明:
1.本站部分文章為轉(zhuǎn)載,其目的在于傳播更多信息�,我們不對(duì)其準(zhǔn)確性、完整性��、及時(shí)性���、有效性和適用性等任何的陳述和保證。本文僅代表作者本人觀點(diǎn)���,并不代表本網(wǎng)贊同其觀點(diǎn)和對(duì)其真實(shí)性負(fù)責(zé)�。
2.思瀚研究院一貫高度重視知識(shí)產(chǎn)權(quán)保護(hù)并遵守中國(guó)各項(xiàng)知識(shí)產(chǎn)權(quán)法律���。如涉及文章內(nèi)容�、版權(quán)等問(wèn)題����,我們將及時(shí)溝通與處理。








 美國(guó)亞利桑那州-記憶綿床墊生產(chǎn)基地?cái)U(kuò)建項(xiàng)目可行性研究報(bào)告
美國(guó)亞利桑那州-記憶綿床墊生產(chǎn)基地?cái)U(kuò)建項(xiàng)目可行性研究報(bào)告 江西宜春-高能量密度動(dòng)力儲(chǔ)能(方形)鋰電池研發(fā)產(chǎn)業(yè)化項(xiàng)目可行性研究報(bào)告
江西宜春-高能量密度動(dòng)力儲(chǔ)能(方形)鋰電池研發(fā)產(chǎn)業(yè)化項(xiàng)目可行性研究報(bào)告 水晶光電-臺(tái)州智能終端用光學(xué)組件技改項(xiàng)目可行性研究報(bào)告
水晶光電-臺(tái)州智能終端用光學(xué)組件技改項(xiàng)目可行性研究報(bào)告 廣西欽州-中偉股份北部灣產(chǎn)業(yè)基地三元項(xiàng)目一期可行性研究報(bào)告
廣西欽州-中偉股份北部灣產(chǎn)業(yè)基地三元項(xiàng)目一期可行性研究報(bào)告 中國(guó)天津-毫米波雷達(dá)研發(fā)中心建設(shè)項(xiàng)目可行性研究報(bào)告
中國(guó)天津-毫米波雷達(dá)研發(fā)中心建設(shè)項(xiàng)目可行性研究報(bào)告 中國(guó)重慶-國(guó)儲(chǔ)珞璜智慧物流園項(xiàng)目可行性研究報(bào)告
中國(guó)重慶-國(guó)儲(chǔ)珞璜智慧物流園項(xiàng)目可行性研究報(bào)告 安徽合肥-高性能微電子級(jí)聚酰亞胺膜材料項(xiàng)目可行性研究報(bào)告
安徽合肥-高性能微電子級(jí)聚酰亞胺膜材料項(xiàng)目可行性研究報(bào)告 廣東汕頭-生殖健康藥品整體升級(jí)項(xiàng)目可行性研究報(bào)告
廣東汕頭-生殖健康藥品整體升級(jí)項(xiàng)目可行性研究報(bào)告