2024-2029年中國(guó)非臨床安全性評(píng)價(jià)行業(yè)市場(chǎng)現(xiàn)狀及發(fā)展前景報(bào)告
思瀚產(chǎn)業(yè)研究院 2024-08-29
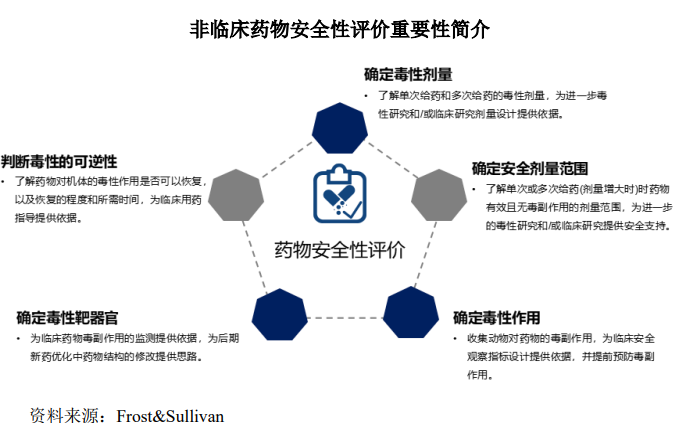
(1)非臨床安全性評(píng)價(jià)簡(jiǎn)介
非臨床安全性評(píng)價(jià)是指通過動(dòng)物體內(nèi)和體外系列研究全面評(píng)價(jià)候選藥物的安全性�����,是新藥申請(qǐng) IND 并進(jìn)入臨床試驗(yàn)或申請(qǐng) NDA/BLA 的必要程序和重要步驟�。主要包括安全藥理學(xué)試驗(yàn)、單次給藥毒性試驗(yàn)����、重復(fù)給藥毒性試驗(yàn)、生殖毒性試驗(yàn)��、遺傳毒性試驗(yàn)�、致癌試驗(yàn)、局部毒性試驗(yàn)���、依賴性試驗(yàn)��、免疫原性研究���、免疫毒性研究、毒代動(dòng)力學(xué)試驗(yàn)等藥物安全性評(píng)價(jià)研究試驗(yàn)����。藥物安全性問題是導(dǎo)致藥物研發(fā)失敗的重要因素,也是上市藥物出現(xiàn)撤市問題的主要原因之一�����。候選藥物在進(jìn)入人體臨床試驗(yàn)/上市前�,均需進(jìn)行全面的安全性評(píng)價(jià)�,從而降低藥物因嚴(yán)重的毒性反應(yīng)而導(dǎo)致研發(fā)失敗的經(jīng)濟(jì)損失�,因此意義重大����。
作為 CRO 行業(yè)的重要環(huán)節(jié)之一,非臨床安全性評(píng)價(jià)與 CRO 行業(yè)發(fā)展趨勢(shì)相同�,呈現(xiàn)同步態(tài)勢(shì)。相較于其他 CRO 環(huán)節(jié)��,非臨床安全性評(píng)價(jià)需要 GLP 資質(zhì)認(rèn)證����,存在較高的準(zhǔn)入門檻,同時(shí)國(guó)際化資質(zhì)認(rèn)證的難度更高����,進(jìn)一步增加了競(jìng)爭(zhēng)壁壘。報(bào)告期內(nèi)�,藥物非臨床安全性評(píng)價(jià)業(yè)務(wù)收入是發(fā)行人主要的營(yíng)收來源,在未來一段時(shí)間內(nèi)��,藥物非臨床安全性評(píng)價(jià)市場(chǎng)的變化和發(fā)展仍會(huì)對(duì)發(fā)行人產(chǎn)生重要的影響���。
(2)全球非臨床安評(píng)市場(chǎng)持續(xù)增長(zhǎng)�����,并呈現(xiàn)寡頭壟斷趨勢(shì)
2018 年全球非臨床安全性評(píng)價(jià)市場(chǎng)規(guī)模為 44.9 億美元���,并于 2022 年增至78.3 億美元����,2018—2022 年的復(fù)合增速為 14.92%��,預(yù)計(jì) 2027 年全球非臨床安全性評(píng)價(jià)市場(chǎng)規(guī)模將達(dá)到 194.1 億美元���,2022—2027 年的復(fù)合增速達(dá)到 19.91%�。
經(jīng)過多年發(fā)展����,2022 年全球安評(píng)市場(chǎng)已呈現(xiàn)寡頭壟斷格局。兩大寡頭 CharlesRiver 和 LabCorp 分別占據(jù)約 27.2%和 14.8%的市場(chǎng)份額����,占據(jù)了較為絕對(duì)的市場(chǎng)競(jìng)爭(zhēng)優(yōu)勢(shì)。
(3)中國(guó)非臨床安評(píng)市場(chǎng)持續(xù)增長(zhǎng)�,行業(yè)集中度不斷提高
受益于近年來國(guó)家創(chuàng)新藥政策鼓勵(lì)、醫(yī)藥市場(chǎng)增長(zhǎng)的良好預(yù)期和生物醫(yī)藥領(lǐng)域投融資高度活躍等因素���,大量制藥企業(yè)紛紛加大了對(duì)創(chuàng)新藥研發(fā)的投入�,也催化誕生了一批新興的生物科技創(chuàng)新公司。非臨床安全性評(píng)價(jià)作為創(chuàng)新藥研發(fā)的核心環(huán)節(jié)之一�,受前述驅(qū)動(dòng)因素影響,近年來市場(chǎng)規(guī)模一度呈現(xiàn)快速增長(zhǎng)的趨勢(shì)����。
盡管短期內(nèi)資本市場(chǎng)進(jìn)入低谷��,醫(yī)?����!?strong>帶量采購(gòu)”和《以臨床價(jià)值為導(dǎo)向的抗腫瘤藥物臨床研發(fā)指導(dǎo)原則》等政策帶來了創(chuàng)新藥發(fā)展的變革期�����,安評(píng)市場(chǎng)增速相對(duì)原先爆發(fā)性增長(zhǎng)有所放緩�。但從長(zhǎng)期來看,安評(píng)行業(yè)保持增長(zhǎng)的核心驅(qū)動(dòng)因素不會(huì)改變��,國(guó)內(nèi)安評(píng)市場(chǎng)仍將保持合理的增長(zhǎng)速率持續(xù)發(fā)展���。
根據(jù) Frost&Sullivan 的統(tǒng)計(jì)數(shù)據(jù)�����,2018 年中國(guó)非臨床安全性評(píng)價(jià)市場(chǎng)規(guī)模約為 21.2 億元人民幣���,并于 2022 年快速增長(zhǎng)至 103.8 億元����,2018 年至 2022 年的復(fù)合增速為 48.77%���。預(yù)計(jì)中國(guó)非臨床安全性評(píng)價(jià)市場(chǎng)規(guī)模于 2027 年將達(dá)至 408.5億元��,2022 年至 2027 年的復(fù)合增速高達(dá) 31.51%��。
相較于全球安評(píng)市場(chǎng)已形成的寡頭壟斷的格局�,中國(guó)安評(píng)市場(chǎng)的集中度仍處于不斷提高階段�����。經(jīng)過 20 余年的發(fā)展�����,中國(guó)安評(píng)市場(chǎng)已經(jīng)形成了幾家龍頭企業(yè),如昭衍新藥���、藥明康德��、益諾思等�����。2022 年中國(guó)安評(píng)市場(chǎng)藥明康德比例最高���,為 20.8%���。其次為昭衍新藥的 14.1%�����。第三名為益諾思�,占比 6.8%��。
非臨床安全性評(píng)價(jià)行業(yè)是一個(gè)具備較高競(jìng)爭(zhēng)壁壘的行業(yè)��,具體表現(xiàn)為除了通過較全的境內(nèi)外 GLP 認(rèn)證/檢查需要較高的資金投入和時(shí)間成本外����,更為重要的是頭部企業(yè)擁有的專業(yè)知識(shí)和業(yè)務(wù)經(jīng)驗(yàn)積累�����、技術(shù)團(tuán)隊(duì)實(shí)力和品牌效應(yīng)等構(gòu)建了長(zhǎng)期的“護(hù)城河”�����,使得新進(jìn)入者難以在短時(shí)間內(nèi)趕超��,也因此競(jìng)爭(zhēng)格局表現(xiàn)為行業(yè)內(nèi)前五較為穩(wěn)定的同時(shí)���,集中度會(huì)不斷提升,呈現(xiàn)強(qiáng)者恒強(qiáng)的“馬太效應(yīng)”�����。
(4)非臨床安評(píng)準(zhǔn)入門檻較高��,市場(chǎng)供需相對(duì)緊張
①GLP 實(shí)驗(yàn)室建設(shè)成本高昂���,國(guó)內(nèi)安評(píng)機(jī)構(gòu)相對(duì)稀缺
非臨床研究質(zhì)量管理規(guī)范(Good Laboratory Practice����,GLP)是針對(duì)非臨床研究機(jī)構(gòu)運(yùn)行管理和非臨床研究項(xiàng)目實(shí)施的質(zhì)量管理體系,各國(guó) GLP 的標(biāo)準(zhǔn)不一�,但均規(guī)定未通過 GLP 認(rèn)證/檢查的機(jī)構(gòu)不得開展非臨床安評(píng)工作。
根據(jù)國(guó)家食品藥品監(jiān)督管理局公告及沙利文統(tǒng)計(jì)數(shù)據(jù)���,2022 年 3 月 24 日�����,國(guó)家食品藥品監(jiān)督管理局發(fā)布《國(guó)家藥監(jiān)局關(guān)于藥物非臨床研究質(zhì)量管理規(guī)范認(rèn)證公告(第 5 號(hào))(2022 年第 27 號(hào))》���,截至該公告日期,共有 78 家機(jī)構(gòu)符合藥物 GLP 要求��,其中同時(shí)具備 OECD GLP 資質(zhì)的實(shí)驗(yàn)室共有 11 家���,接受過 FDAGLP 檢查的機(jī)構(gòu)共有 10 家。
在上述 78 家機(jī)構(gòu)中����,存在大量科研院所,整體活躍的盈利性質(zhì) GLP 機(jī)構(gòu)約 30 余家�����,具有一定規(guī)模的進(jìn)一步減少。面對(duì)國(guó)內(nèi)創(chuàng)新藥研發(fā)熱潮和海外訂單的轉(zhuǎn)移�,通過國(guó)際化資質(zhì)認(rèn)證的安評(píng)機(jī)構(gòu)數(shù)量有限,難以較好滿足我國(guó)新藥研發(fā)國(guó)際化的需求�����。
②非臨床安全性評(píng)價(jià)環(huán)節(jié)外包需求強(qiáng)烈
由于 GLP 實(shí)驗(yàn)室建設(shè)周期相對(duì)較長(zhǎng)�����、認(rèn)證過程較為繁瑣�,相關(guān)實(shí)驗(yàn)儀器和設(shè)施的固定資產(chǎn)開支較高,藥物研發(fā)機(jī)構(gòu)更愿意將安評(píng)試驗(yàn)外包而非自行建設(shè)�,國(guó)內(nèi)目前也幾乎沒有制藥企業(yè)自行建設(shè) GLP 實(shí)驗(yàn)室。據(jù)統(tǒng)計(jì)��,從藥物研發(fā)各主要環(huán)節(jié)外包滲透率來看��,藥理毒理評(píng)估即非臨床安全性評(píng)價(jià)所在環(huán)節(jié)外包滲透率最高��。藥物研發(fā)機(jī)構(gòu)在非臨床安全性評(píng)價(jià)環(huán)節(jié)的較高外包意愿加之安評(píng)機(jī)構(gòu)受限于 GLP 資質(zhì)認(rèn)證要求存在準(zhǔn)入門檻����,市場(chǎng)供需相對(duì)緊張。
(5)動(dòng)物房面積限制產(chǎn)能瓶頸��,頭部企業(yè)紛紛加大布局
CRO 行業(yè)屬于技術(shù)密集型行業(yè),產(chǎn)能主要受制于實(shí)驗(yàn)設(shè)施面積和技術(shù)人員數(shù)量方面�。由于實(shí)驗(yàn)動(dòng)物在非臨床安全性評(píng)價(jià)中起到至關(guān)重要的作用,實(shí)驗(yàn)設(shè)施面積尤其是動(dòng)物房面積顯得尤為重要���。隨著非臨床安全性評(píng)價(jià)市場(chǎng)的高速發(fā)展��,頭部非臨床安評(píng)企業(yè)紛紛加大動(dòng)物房設(shè)施投入��,持續(xù)擴(kuò)大產(chǎn)能規(guī)模�����,搶占未來市場(chǎng)份額��。
第1章 非臨床安全性評(píng)價(jià)行業(yè)相關(guān)概述
1.1 非臨床安全性評(píng)價(jià)行業(yè)定義及特征
1.1.1 非臨床安全性評(píng)價(jià)行業(yè)定義
1.1.2 行業(yè)特征分析
1.2 非臨床安全性評(píng)價(jià)行業(yè)商業(yè)模式分析
1.3 非臨床安全性評(píng)價(jià)行業(yè)主要風(fēng)險(xiǎn)因素分析
1.3.1 經(jīng)營(yíng)風(fēng)險(xiǎn)分析
1.3.2 管理風(fēng)險(xiǎn)分析
1.3.3 法律風(fēng)險(xiǎn)分析
1.4 非臨床安全性評(píng)價(jià)行業(yè)壁壘分析
1.4.1 人才壁壘
1.4.2 經(jīng)營(yíng)壁壘
1.4.3 品牌壁壘
第2章 中國(guó)非臨床安全性評(píng)價(jià)行業(yè)運(yùn)行環(huán)境分析
2.1 中國(guó)非臨床安全性評(píng)價(jià)運(yùn)行經(jīng)濟(jì)環(huán)境分析
2.1.1 經(jīng)濟(jì)發(fā)展現(xiàn)狀分析
2.1.2 當(dāng)前經(jīng)濟(jì)主要問題
2.1.3 未來經(jīng)濟(jì)運(yùn)行與政策展望
2.2 中國(guó)非臨床安全性評(píng)價(jià)產(chǎn)業(yè)政策環(huán)境分析
2.2.1 非臨床安全性評(píng)價(jià)行業(yè)監(jiān)管體制
2.2.2 非臨床安全性評(píng)價(jià)行業(yè)主要法規(guī)
2.2.3 主要非臨床安全性評(píng)價(jià)產(chǎn)業(yè)政策
2.3 中國(guó)非臨床安全性評(píng)價(jià)產(chǎn)業(yè)社會(huì)環(huán)境分析
2.3.1 人口規(guī)模及結(jié)構(gòu)
2.3.2 教育環(huán)境分析
2.3.3 文化環(huán)境分析
2.3.4 居民收入及消費(fèi)狀況分析
2.4 非臨床安全性評(píng)價(jià)行業(yè)技術(shù)環(huán)境
第3章 2023年全球非臨床安全性評(píng)價(jià)行業(yè)運(yùn)行分析
3.1 全球現(xiàn)代服務(wù)業(yè)發(fā)展分析
3.1.1 發(fā)展概況
3.1.2 發(fā)展特征
3.1.3 經(jīng)驗(yàn)借鑒
3.1.4 發(fā)展趨勢(shì)
3.2 世界主要國(guó)家非臨床安全性評(píng)價(jià)行業(yè)發(fā)展現(xiàn)狀及對(duì)我國(guó)的啟示
3.2.1 美國(guó)
3.2.2 英國(guó)
3.2.3 日本
3.3 2024-2029年全球非臨床安全性評(píng)價(jià)行業(yè)發(fā)展趨勢(shì)預(yù)測(cè)
第4章 2023年中國(guó)非臨床安全性評(píng)價(jià)行業(yè)經(jīng)營(yíng)情況分析
4.1 非臨床安全性評(píng)價(jià)行業(yè)發(fā)展概況分析
4.1.1 行業(yè)發(fā)展歷程回顧
4.1.2 行業(yè)發(fā)展特點(diǎn)分析
1���、非臨床安全性評(píng)價(jià)行業(yè)所處生命周期
2、技術(shù)變革與行業(yè)革新對(duì)非臨床安全性評(píng)價(jià)行業(yè)的影響
3���、差異化分析
4.2 非臨床安全性評(píng)價(jià)行業(yè)供給態(tài)勢(shì)分析
4.2.1 非臨床安全性評(píng)價(jià)行業(yè)企業(yè)數(shù)量分析
4.2.2 非臨床安全性評(píng)價(jià)行業(yè)企業(yè)所有制結(jié)構(gòu)分析
4.2.3 非臨床安全性評(píng)價(jià)行業(yè)企業(yè)注冊(cè)資本情況
4.2.4 非臨床安全性評(píng)價(jià)行業(yè)企業(yè)區(qū)域分布情況
4.3 非臨床安全性評(píng)價(jià)行業(yè)市場(chǎng)規(guī)模態(tài)勢(shì)分析
4.3.1 中國(guó)非臨床安全性評(píng)價(jià)行業(yè)市場(chǎng)規(guī)模情況
4.3.2 中國(guó)非臨床安全性評(píng)價(jià)行業(yè)市場(chǎng)結(jié)構(gòu)分析
第5章 2023年中國(guó)非臨床安全性評(píng)價(jià)行業(yè)競(jìng)爭(zhēng)格局分析
5.1 行業(yè)總體市場(chǎng)競(jìng)爭(zhēng)狀況分析
5.1.1 非臨床安全性評(píng)價(jià)行業(yè)競(jìng)爭(zhēng)結(jié)構(gòu)分析
5.1.2 非臨床安全性評(píng)價(jià)行業(yè)企業(yè)間競(jìng)爭(zhēng)格局分析
5.1.3 非臨床安全性評(píng)價(jià)行業(yè)集中度分析
5.1.4 非臨床安全性評(píng)價(jià)行業(yè)SWOT分析
5.2 中國(guó)非臨床安全性評(píng)價(jià)行業(yè)競(jìng)爭(zhēng)格局綜述
5.2.1 中國(guó)非臨床安全性評(píng)價(jià)行業(yè)五力競(jìng)爭(zhēng)分析
5.2.2 中國(guó)非臨床安全性評(píng)價(jià)行業(yè)競(jìng)爭(zhēng)優(yōu)勢(shì)分析
5.2.3 2019-2023年我國(guó)非臨床安全性評(píng)價(jià)市場(chǎng)競(jìng)爭(zhēng)預(yù)測(cè)
5.2.4 非臨床安全性評(píng)價(jià)市場(chǎng)競(jìng)爭(zhēng)策略分析
第6章 非臨床安全性評(píng)價(jià)行業(yè)上下游行業(yè)分析
6.1 非臨床安全性評(píng)價(jià)產(chǎn)業(yè)鏈分析
6.2 上游行業(yè)分析
6.2.1 上游行業(yè)發(fā)展現(xiàn)狀
6.2.2 上游行業(yè)發(fā)展趨勢(shì)預(yù)測(cè)
6.2.3 上游行業(yè)新動(dòng)態(tài)及其對(duì)非臨床安全性評(píng)價(jià)行業(yè)的影響
6.3 下游行業(yè)分析
6.3.1 下游行業(yè)發(fā)展現(xiàn)狀
6.3.2 下游行業(yè)發(fā)展趨勢(shì)預(yù)測(cè)
6.3.3 下游行業(yè)新動(dòng)態(tài)及其對(duì)非臨床安全性評(píng)價(jià)行業(yè)的影響
第7章 2024-2029年非臨床安全性評(píng)價(jià)行業(yè)各區(qū)域市場(chǎng)概況及前景預(yù)測(cè)
7.1 華北地區(qū)非臨床安全性評(píng)價(jià)行業(yè)分析
7.1.1 區(qū)位條件簡(jiǎn)介及經(jīng)濟(jì)運(yùn)行情況分析
7.1.2 2019-2023年華北地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模分析
7.1.3 2024-2029年華北地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模預(yù)測(cè)
7.2 東北地區(qū)非臨床安全性評(píng)價(jià)行業(yè)分析
7.2.1 區(qū)域經(jīng)濟(jì)環(huán)境分析
7.2.2 2019-2023年東北地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模分析
7.2.3 2024-2029年東北地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模預(yù)測(cè)
7.3 華東地區(qū)非臨床安全性評(píng)價(jià)行業(yè)分析
7.3.1 區(qū)域經(jīng)濟(jì)環(huán)境分析
7.3.2 2019-2023年華東地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模分析
7.3.3 2024-2029年華東地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模預(yù)測(cè)
7.4 華中地區(qū)非臨床安全性評(píng)價(jià)行業(yè)分析
7.4.1 區(qū)域經(jīng)濟(jì)環(huán)境分析
7.4.2 2019-2023年華中地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模分析
7.4.3 2024-2029年華中地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模預(yù)測(cè)
7.5 華南地區(qū)非臨床安全性評(píng)價(jià)行業(yè)分析
7.5.1 區(qū)域經(jīng)濟(jì)環(huán)境分析
7.5.2 2019-2023年華南地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模分析
7.5.3 2024-2029年華南地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模預(yù)測(cè)
7.6 西南地區(qū)非臨床安全性評(píng)價(jià)行業(yè)分析
7.6.1 區(qū)域經(jīng)濟(jì)環(huán)境分析
7.6.2 2019-2023年西南地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模分析
7.6.3 2024-2029年西南地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模預(yù)測(cè)
7.7 西北地區(qū)非臨床安全性評(píng)價(jià)行業(yè)分析
7.7.1 區(qū)域經(jīng)濟(jì)環(huán)境分析
7.7.2 2019-2023年西北地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模分析
7.7.3 2024-2029年西北地區(qū)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模預(yù)測(cè)
第8章 中國(guó)非臨床安全性評(píng)價(jià)行業(yè)重點(diǎn)企業(yè)經(jīng)營(yíng)情況分析
8.1 公司1
8.1.1 企業(yè)簡(jiǎn)介
8.1.2 企業(yè)經(jīng)營(yíng)狀況
8.1.3 企業(yè)競(jìng)爭(zhēng)力分析
8.1.4 產(chǎn)品/服務(wù)特色
8.2 公司2
8.2.1 企業(yè)簡(jiǎn)介
8.2.2 企業(yè)經(jīng)營(yíng)狀況
8.2.3 企業(yè)競(jìng)爭(zhēng)力分析
8.2.4 產(chǎn)品/服務(wù)特色
8.3 公司3
8.3.1 企業(yè)簡(jiǎn)介
8.3.2 企業(yè)經(jīng)營(yíng)狀況
8.3.3 企業(yè)競(jìng)爭(zhēng)力分析
8.3.4 產(chǎn)品/服務(wù)特色
8.4 公司4
8.4.1 企業(yè)簡(jiǎn)介
8.4.2 企業(yè)經(jīng)營(yíng)狀況
8.4.3 企業(yè)競(jìng)爭(zhēng)力分析
8.4.4 產(chǎn)品/服務(wù)特色
8.5 公司5
8.5.1 企業(yè)簡(jiǎn)介
8.5.2 企業(yè)經(jīng)營(yíng)狀況
8.5.3 企業(yè)競(jìng)爭(zhēng)力分析
8.5.4 產(chǎn)品/服務(wù)特色
8.6 公司6
8.6.1 企業(yè)簡(jiǎn)介
8.6.2 企業(yè)經(jīng)營(yíng)狀況
8.6.3 企業(yè)競(jìng)爭(zhēng)力分析
8.6.4 產(chǎn)品/服務(wù)特色
第9章 2024-2029年中國(guó)非臨床安全性評(píng)價(jià)行業(yè)發(fā)展前景預(yù)測(cè)
9.1 2024-2029年中國(guó)非臨床安全性評(píng)價(jià)行業(yè)前景預(yù)測(cè)
9.1.1 2024-2029年中國(guó)非臨床安全性評(píng)價(jià)行業(yè)規(guī)模預(yù)測(cè)
9.1.2 2024-2029年中國(guó)非臨床安全性評(píng)價(jià)產(chǎn)業(yè)的前景及趨勢(shì)
9.2 2024-2029年中國(guó)非臨床安全性評(píng)價(jià)行業(yè)發(fā)展趨勢(shì)預(yù)測(cè)
9.2.1 非臨床安全性評(píng)價(jià)行業(yè)發(fā)展驅(qū)動(dòng)因素分析
9.2.2 非臨床安全性評(píng)價(jià)行業(yè)發(fā)展制約因素分析
9.3 2024-2029年非臨床安全性評(píng)價(jià)行業(yè)發(fā)展存在的問題和建議
免責(zé)聲明:
1.本站部分文章為轉(zhuǎn)載,其目的在于傳播更多信息��,我們不對(duì)其準(zhǔn)確性�����、完整性、及時(shí)性�����、有效性和適用性等任何的陳述和保證�����。本文僅代表作者本人觀點(diǎn)����,并不代表本網(wǎng)贊同其觀點(diǎn)和對(duì)其真實(shí)性負(fù)責(zé)。
2.思瀚研究院一貫高度重視知識(shí)產(chǎn)權(quán)保護(hù)并遵守中國(guó)各項(xiàng)知識(shí)產(chǎn)權(quán)法律���。如涉及文章內(nèi)容���、版權(quán)等問題,我們將及時(shí)溝通與處理��。








 美國(guó)亞利桑那州-記憶綿床墊生產(chǎn)基地?cái)U(kuò)建項(xiàng)目可行性研究報(bào)告
美國(guó)亞利桑那州-記憶綿床墊生產(chǎn)基地?cái)U(kuò)建項(xiàng)目可行性研究報(bào)告 江西宜春-高能量密度動(dòng)力儲(chǔ)能(方形)鋰電池研發(fā)產(chǎn)業(yè)化項(xiàng)目可行性研究報(bào)告
江西宜春-高能量密度動(dòng)力儲(chǔ)能(方形)鋰電池研發(fā)產(chǎn)業(yè)化項(xiàng)目可行性研究報(bào)告 水晶光電-臺(tái)州智能終端用光學(xué)組件技改項(xiàng)目可行性研究報(bào)告
水晶光電-臺(tái)州智能終端用光學(xué)組件技改項(xiàng)目可行性研究報(bào)告 廣西欽州-中偉股份北部灣產(chǎn)業(yè)基地三元項(xiàng)目一期可行性研究報(bào)告
廣西欽州-中偉股份北部灣產(chǎn)業(yè)基地三元項(xiàng)目一期可行性研究報(bào)告 中國(guó)天津-毫米波雷達(dá)研發(fā)中心建設(shè)項(xiàng)目可行性研究報(bào)告
中國(guó)天津-毫米波雷達(dá)研發(fā)中心建設(shè)項(xiàng)目可行性研究報(bào)告 中國(guó)重慶-國(guó)儲(chǔ)珞璜智慧物流園項(xiàng)目可行性研究報(bào)告
中國(guó)重慶-國(guó)儲(chǔ)珞璜智慧物流園項(xiàng)目可行性研究報(bào)告 安徽合肥-高性能微電子級(jí)聚酰亞胺膜材料項(xiàng)目可行性研究報(bào)告
安徽合肥-高性能微電子級(jí)聚酰亞胺膜材料項(xiàng)目可行性研究報(bào)告 廣東汕頭-生殖健康藥品整體升級(jí)項(xiàng)目可行性研究報(bào)告
廣東汕頭-生殖健康藥品整體升級(jí)項(xiàng)目可行性研究報(bào)告