治療用生物制品1類創(chuàng)新藥物研發(fā)項目可行性研究報告
思瀚產(chǎn)業(yè)研究院 舒泰神 2022-12-23
(一)項目基本情況
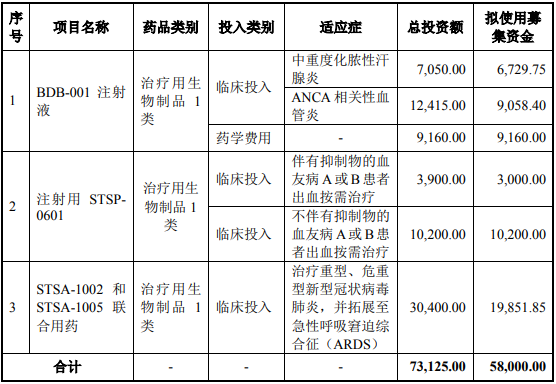
本次擬使用募集資金用于創(chuàng)新藥物的臨床研究�,項目總投資金額為73,125.00萬元�����,擬使用募集資金 58,000.00萬元��,以滿足部分在研產(chǎn)品從現(xiàn)階段
至 2025 年的研發(fā)資金需求����。具體如下:單位:萬元
各研發(fā)項目的具體開展情況如下:
(1)適應癥:中重度化膿性汗腺炎(HS)
1)研發(fā)背景
化 膿 性 汗 腺 炎 ( HidradenitisSuppurativa , HS ) 又 稱 反 常 性 痤 瘡(Acneinversanversa���,AI)�,是一種具有家族傾向���、反復發(fā)作的慢性炎癥性皮膚病���。其常見臨床表現(xiàn)為黑色粉刺、深在性����、炎癥性皮損,繼而形成�、疼痛的囊腫��、膿腫����、竇道、瘢痕等���,可伴隨或繼發(fā)多種系統(tǒng)性疾病����,如糖尿病、自身炎癥性疾病等��,多發(fā)于腋下�、乳房下皺襞、腹部皺襞�����、腹股溝�����、臀部�、大腿內(nèi)側(cè)、會陰和肛周等頂泌汗腺分布區(qū)域���,嚴重影響患者的生活質(zhì)量����。全球報告 HS不同時期����,不同區(qū)域 HS 患病率不同���。
90 年代 JemecGB 等研究顯示全球患病率范圍在 1%~4%之間。近代 Zouboulis 等研究顯示歐洲平均患病率為 1%��。而Cosmatos 等研究發(fā)現(xiàn)美國患病率為 0.053%�����,估計有 146,000~162,000 例患者���。法國最近的一項大型流行病學調(diào)查報告顯示��,患病率為 0.97%�����。英國患病人數(shù)估計 10 萬左右�,每年住院治療患者超過 2000 人���,根據(jù)臨床登記 HS 患者數(shù)量估計患病率為 0.25%~8%。
目前針對HS的治療手段有限�����,且往往存在愈合不佳、經(jīng)常復發(fā)的問題��。中國目前尚無獲批用于治療 HS 的生物制劑���,國外獲批的也僅有阿達木單抗(抗TNF-α單抗)一種(FDA2015年9月批準)���,但仍有大約50%的中度至重度HS患者對阿達木單抗治療無響應。中重度HS引起的疼痛����、慢性化膿和持續(xù)惡臭給患者的生活帶來巨大的痛苦和經(jīng)濟負擔,臨床迫切需要開發(fā)治療HS的有效治療藥物����。
HS 的發(fā)病機理與炎癥、細菌感染���、遺傳�、肥胖��、吸煙以及機械壓力有關����。研究顯示����,多種炎癥因子參與 HS 的發(fā)病過程���,TNF-α��、IL-1β�����、IL-17���、IL-12、IL-23 等細胞因子都明顯升高��。補體系統(tǒng)中的 C5a 具有強烈的趨化作用��,可以誘導中性粒細胞�、嗜酸粒細胞和單核細胞向炎癥部位的移動。此外�����,C5a 對免疫應答有明顯增強作用����,可誘導單核細胞分泌 IL-1、IL-6�����、IL-8 及 TNF-α等細胞因子��。
因此提示阻斷 C5a 具有對化膿性汗腺炎強有力的治療潛力�,其可以有效控制導致化膿性汗腺炎關鍵致病因素的炎癥因子水平,從而控制HS相關疾病癥狀�����。BDB-001 注射液為重組抗人 C5a 人源化單克隆抗體注射液���,可以特異性的阻斷過敏毒素(C5a)誘導的生物學活性�,如中性粒細胞的活化��、細胞內(nèi)顆粒酶的釋放��、炎癥調(diào)節(jié)因子水平的上升�����、氧呼吸風暴的爆發(fā)等;同時不影響 C5裂解形成 C5a 及膜攻擊復合物(MAC)的形成���,因此在治療 HS 上存在巨大的潛力�����。
公司在中國境內(nèi)對 BDB-001 獨立開展了針對化膿性汗腺炎等適應癥的臨床研究���。BDB-001 注射液治療中重度化膿性汗腺炎的適應癥于 2018 年 7 月在國內(nèi)取得臨床試驗批件,2019年 10月第一例受試者入組��。2021年 3月國家藥品監(jiān)督管理局藥物臨床試驗登記與信息公示平臺公示了單克隆抗體藥物 BDB-001 注射液治療中重度化膿性汗腺炎的 Ib/II期臨床試驗的相關信息��。
2)實施主體�����、當前研發(fā)階段及預計進展
BDB-001 注射液臨床試驗項目原先實施主體為舒泰神母公司及全資子公司德豐瑞����。截至本預案公告日,舒泰神已與全資子公司德豐瑞簽署了吸收合并協(xié)議���,后續(xù)項目實施主體為舒泰神母公司�����。
BDB-001 注射液項目(適應癥:HS)當前研發(fā)階段處于臨床 Ib/II 期���,臨床III期試驗預計啟動時間為 2023 年四季度。
3)未來前景
目前臨床上針對化膿性汗腺炎的藥物治療主要包括抗生素�����、抗炎藥�、激素制劑、全身用維 A 酸和中藥�。盡管目前的藥物抗感染、抗炎�、抗增生等雖然在短期內(nèi)獲得較好的治療效果,但是復發(fā)的概率仍然很高���。國外用于治療HS的生物制劑也僅有阿達木單抗(Adalimumab)����,其于 2015 年 09 月經(jīng) FDA 批準作為中重度化膿性汗腺炎治療藥物�。目前正處在臨床研究階段生物制劑有同樣靶向TNF-α的英夫利昔單抗(Infliximab)和依那西普(Etanercept)����,以及 IL-1受體拮抗劑��、IL-23p19 抗體�����。
即使已獲批的阿達木單抗�,仍有大約 50%的中度至重度 HS 患者對阿達木單抗治療無響應。中重度 HS 引起的疼痛�、慢性化膿和持續(xù)惡臭給患者的生活帶來巨大的痛苦和經(jīng)濟負擔,中國目前尚無治療HS的有效藥物���,臨床迫切需要開發(fā)治療 HS 的有效治療藥物���。
單克隆抗體藥物 BDB001 注射液是針對 C5a 靶點的國內(nèi)首個、最早進入臨床研究的創(chuàng)新藥物�����,有望廣泛應用于自身免疫性疾病和感染性疾病���,為HS的藥物治療提供新的解決路徑����。由于該藥目前獲批臨床試驗的適應癥均無同類型藥物上市,市場潛能較大����。
另外,近年來研究顯示����,中性粒細胞異?����;罨?���、補體系統(tǒng)異常、多種細胞因子(如 TNF-α�、IL-1 和 IL-17 等)分泌異常在中性粒細胞異常活化為特征的皮膚病-嗜中性皮?。╪eutrophilicdermatoses,ND)的發(fā)病中起著關鍵作用�。
這類疾病主要有壞疽性膿皮病、Sweet綜合征�����、白塞病、中性粒細胞性汗腺炎��、斯蒂爾病�����、中性粒細胞性蕁麻疹��、膿皰型銀屑病�、IgA 天皰瘡、皮膚皺褶無菌性膿皰病���、粘液性角化病���、嬰兒肢端膿皰病等。上述疾病中目前仍有大約1/3的患者一線藥物治療無效�����。
因此���,ND的治療對于皮膚科醫(yī)師而言仍是一個巨大的挑戰(zhàn)�。與BDB-001注射液同靶點同細胞系產(chǎn)品IFX-1(vilobelimab)在壞疽性膿皮病(PG)患者中開展的Ⅱa期臨床研究結(jié)果顯示�����,高劑量組的 7名患者中有 6名(85.7%)潰瘍完全閉合��,療效與患者血漿中 C5a 水平降低相關���。IFX-1(vilobelimab)已被美國食品和藥物管理局(FDA)和歐洲歐洲藥品管理局(EMA)授予治療 PG的孤兒藥資格����,InflaRx 公司即將開展 IFX-1(vilobelimab)治療PG的Ⅲ期臨床研究�。
BDB-001注射液通過阻斷C5a的生物學作用���,在一系列中性粒細胞異?���;罨癁樘卣鞯钠つw病中亦有可能具有良好的治療作用��,目前尚無同類型藥物獲批用于上述疾病的治療��,若 BDB-001 注射液后續(xù)成功拓展相關適應癥���,市場潛力巨大���。
(2)適應癥:ANCA 相關性血管炎
1)研發(fā)背景
ANCA 相關性血管炎又稱抗中性粒細胞胞漿抗體(ANCA)相關性血管炎����,是一組以血清中能夠檢測到 ANCA 為最突出特點的系統(tǒng)性小血管炎�。ANCA 相關性血管炎是一種全身性自身免疫性疾病,是由于補體系統(tǒng)(免疫系統(tǒng)的一部分)的過度激活引起��。補體系統(tǒng)的過度激活會進一步激活中性粒細胞�,引起炎癥并最終破壞小血管。ANCA 相關性血管炎臨床表現(xiàn)變化多端���,可以累積全身多個器官系統(tǒng)��,患者常有發(fā)熱���,疲乏,肌肉關節(jié)酸痛等全身炎癥反應癥狀��。最常受累的器官是肺和腎��。
腎臟損害患者多出現(xiàn)蛋白尿、血尿�、各種管型、水腫和腎性高血壓等����,甚至出現(xiàn)腎功能不全,病情急劇惡化導致死亡�����。肺部病變主要出現(xiàn)咳嗽��、咯血�����、現(xiàn)呼吸困難或哮喘癥狀�,患者常發(fā)生雙側(cè)中下肺小葉性炎癥�����,甚至出現(xiàn)肺間質(zhì)纖維化�����。其他系統(tǒng)的臨床表現(xiàn)包括:患者常出現(xiàn)耳鼻喉的臨床癥狀包括鼻塞,流涕����,鼻竇炎,分泌性中耳炎等����;神經(jīng)系統(tǒng)受累最常見的是多發(fā)性單神經(jīng)炎;消化系統(tǒng)表現(xiàn)為消化道出血����、胰腺炎以及由腸道缺血引起的腹痛,嚴重者可出現(xiàn)穿孔����;心血管事件如心肌梗死,心力衰竭等的發(fā)生率較正常人升高�����,成為 AAV患者重要的死亡原因����。
目前,ANCA 相關血管炎的治療包括非特異性免疫抑制劑(環(huán)磷酰胺或利妥昔單抗)���,以及聯(lián)合每日糖皮質(zhì)激素長期給藥�����,但可能導致顯著的臨床風險���,包括因感染導致的死亡����,亟需更好的療法���。與 BDB-001 作用靶點相近的藥物Tavneos(Avacopan)��,作為首個 ANCA 相關血管炎新藥�����,已在日本���、美國���、歐盟等地陸續(xù)上市���,其與標準療法聯(lián)用���,輔助治療嚴重活動性抗中性粒細胞胞漿自身抗體(ANCA)相關血管炎,主要包括顯微鏡下多血管炎(MPA)和肉芽腫伴多血管炎(GPA)��。公司 BDB-001 注射液用于 ANCA 相關性血管炎的國內(nèi)臨床試驗正在推進中��。
2)實施主體��、當前研發(fā)階段及預計進展
BDB-001 注射液臨床試驗項目原先實施主體為舒泰神母公司及全資子公司德豐瑞����。截至本預案公告日,舒泰神已與全資子公司德豐瑞簽署了吸收合并協(xié)議�����,后續(xù)項目實施主體為舒泰神母公司���。
BDB-001 注射液(適應癥:ANCA 相關性血管炎)當前研發(fā)階段處于臨床Ib/II期��,預計 2024 年下半年與 CDE溝通并啟動臨床 III期��。
3)未來前景
BDB-001 作為國內(nèi)首個以 C5a 為靶點治療 ANCA 相關性血管炎的藥物��,其作用機制已得到同類藥物的驗證�����。如果獲批上市���,即可有效緩解 ANCA 相關性血管炎患者的癥狀和體征���,減少糖皮質(zhì)激素的用量,甚至取代糖皮質(zhì)激素的長
期使用���,從而減少其副作用的發(fā)生�����,提高患者生活質(zhì)量�����,降低醫(yī)療花費��,具有巨大的經(jīng)濟效益和社會效益�����。
(3)BDB-001 注射液項目藥學費用
藥學費用投入旨在完成 BDB-001 注射液上市前全部所需的藥學研究�,主要工作內(nèi)容包含可比性研究�����、工藝驗證���、動態(tài)核查���、現(xiàn)場檢查、質(zhì)量研究�����、穩(wěn)定性檢驗��、技術研究�����、委托檢測�����、注冊等環(huán)節(jié)。
2��、注射用 STSP-0601
(1)研發(fā)背景
血友病是一種 X 染色體連鎖的隱性遺傳性出血性疾病����,其遺傳特點是男性發(fā)病,女性攜帶��。每 10 萬男孩中有 15 到 20 人發(fā)病��,此發(fā)病率在所調(diào)查的不同的種族和地域之間沒有差異�。發(fā)病率以血友病 A 最多,占 85%�,余下主要為血友病 B,其他類型血友病較少見�����。
2018 年 5 月 11 日�,國家衛(wèi)生健康委員會等 5部門聯(lián)合制定了《第一批罕見病目錄》,血友病被收錄其中�����。血友病 A表現(xiàn)為凝血因子 VIII(FVIII)缺乏�����,血友病 B 表現(xiàn)為凝血因子 IX(FIX)缺乏,均由相應的凝血因子基因突變引起�����。血友病的臨床特征性表現(xiàn)為出血傾向�,主要表現(xiàn)為關節(jié)�、肌肉和深部組織出血等。若反復出血���,不及時治療可導致關節(jié)畸形和(或)假腫瘤形成���,嚴重者可危及生命。血友病目前仍無徹底治愈的療法�,凝血因子替代治療是首選的治療方法。
血友病 A 患者接受 FVIII 替代治療后產(chǎn)生的同種中和性抗體成為抑制物����。持續(xù)合并存在伴抑制物是血友病的嚴重并發(fā)癥,將導致血友病患者出血癥狀更加難控制����,致命性出血風險增高�。公司研發(fā)的凝血因子 X 激活劑“注射用STSP-0601”是國家 I 類治療用生物制品����,凝血因子 X 激活劑“注射用 STSP-0601”是由圓斑蝰蛇毒液分離純化而得的凝血因子 X 激活劑。該蛋白含有高度復雜的糖基化修飾�����,所攜帶糖鏈多為富含唾液酸的多天線糖型��。從作用機理看��,
凝血因子 X 激活劑注射用 STSP0601 可特異性地激活凝血因子 X(FX)�����,使活性部位充分暴露生成凝血因子 X激活劑(Fxa)��,F(xiàn)Xa進而與損傷部位激活的血小板����、FVa 以及鈣離子形成凝血酶原復合物,從而增加凝血酶生成�����,凝血酶激活損傷部位的血小板和凝血因子 V(FV)、凝血因子(VIII)并通過纖維蛋白原向纖維蛋白的轉(zhuǎn)換形成止血栓���,達到幫助出血患者止血的目的�。注射用STSP-0601 治療伴有抑制物的血友病出血機制明確���,已有的安全性和有效性數(shù)據(jù)支持開展注射用 STSP-0601 用于伴有抑制物的血友病 A 或 B 患者出血按需治療的臨床試驗。
2019年 4月 30日�����,公司向國家藥品監(jiān)督管理局提交關于凝血因子 X激活劑“注射用 STSP-0601”的新藥臨床試驗申請�����,并于 2019年 5月 14日收到國家藥品監(jiān)督管理局《受理通知書》�,屬于“特殊審批程序”品種;2019 年 7月 31 日���,公司收到國家藥品監(jiān)督管理局簽發(fā)的凝血因子 X 激活劑“注射用 STSP-0601”《臨床試驗通知書》(CXSL1900045)��,同意按照提交的方案開展臨床試驗��;2019 年 12 月��,關于凝血因子 X 激活劑“注射用 STSP-0601”的藥物 I 期臨床試驗信息于國家藥品監(jiān)督管理局藥物臨床試驗登記與信息公示平臺公示(登記號:CTR20191930)�;
2020 年 1 月第一例受試者入組,已于 2021 年 8 月完成伴抑制物患者的 I 期臨床試驗����,安全性和耐受性良好;2021 年 9 月�,公司啟動了注射用 STSP-0601 Ib/II期臨床試驗;2022年 9月 6 日����,STSP-0601被 CDE 納入突破性治療品種,說明監(jiān)管機構(gòu)認可本品已有的臨床數(shù)據(jù)顯示出明確的臨床優(yōu)勢��;CDE 對納入突破性治療藥物審評程序的品種會采取一系列支持政策����,加強指導并促進藥物研發(fā)進程,優(yōu)先處理相關溝通交流����,加速后續(xù)審批流程。
(2)實施主體���、當前研發(fā)階段及預計進展
注射用 STSP-0601 項目的實施主體為舒泰神母公司及全資子公司諾維康���?!鞍橛幸种莆锏难巡?A 或 B 患者出血按需治療”適應癥當前研發(fā)階段處于臨床 Ib/II期���,預計 2022 年底或 2023年初結(jié)束當前階段����;臨床 III 期試驗預計于 2023 年開展�����。
“不伴有抑制物的血友病 A 或 B 患者出血按需治療”適應癥當前已收到國家 藥 品 監(jiān) 督 管 理 局 的 《 藥 物 臨 床 試 驗 批 準 通 知 書 》( 通 知 書 編 號 :2022LP01612)��,該適應癥系在伴抑制物臨床試驗基礎上進行的拓展��,預計在2023年上半年可以開展有效性臨床試驗�,2023 年下半年可進入臨床 III期����。
(3)未來前景
按需治療需要充分考慮患者對于已有治療手段的可獲得性,以及患者自身的經(jīng)濟承受能力��。根據(jù)《凝血因子 VIII/IX 抑制物診斷與治療中國指南》,目前用于伴抑制物的血友病患者出血按需治療的藥物有活化凝血酶原復合物(aPCC)和重組人凝血因子 VIIa(rhVIIa)兩種�。其中,由于我國尚無 aPCC 制劑供應�,如果無法獲得 rhVIIa,一般使用國產(chǎn)凝血酶原復合物 PCC 止血��,PCC 有效止血率僅為 50%��,且存在免疫記憶反應���、病毒感染和血栓形成等風險���;目前國內(nèi)可用的重組人凝血因子VIIa僅有諾和諾德的進口產(chǎn)品諾其,諾其有效止血率約31-63%����,但諾其在國內(nèi)單支售價約 5000 元,單次出血事件需給藥 1~10 次不等����,治療費用約為 3萬~30萬,限制了臨床廣泛應用���。
因此����,研發(fā)安全有效且價格可接受的治療藥物是國內(nèi)伴有抑制物的血友病患者急性出血發(fā)作亟待解決的臨床需求。此外���,隨著注射用 STSP-0601 項目研發(fā)的推進���,將瞄準滿足不伴有抑制物的血友病患者的臨床需求,進一步拓寬市場空間��。
本項目是具有自主知識產(chǎn)權(quán)的國家I類創(chuàng)新生物藥物���,該產(chǎn)品結(jié)構(gòu)復雜����,生產(chǎn)工藝和質(zhì)量控制技術難度高�,具有較高的研發(fā)技術門檻�����。其研發(fā)的成功將為血友病患者提供安全�����、有效且經(jīng)濟可接受的治療藥物,從而大幅提高血友病患者接受治療的比例����,減輕患者負擔,創(chuàng)造社會效益����。
3、STSA-1002 和 STSA-1005 聯(lián)合用藥
(1)研發(fā)背景
急性呼吸窘迫綜合征(ARDS)是一種在短時間內(nèi) (1 周內(nèi))發(fā)生的急性����、彌漫性的炎癥性肺損傷,由嚴重感染��、創(chuàng)傷�、休克等各種肺內(nèi)外致病因素導致,臨床表現(xiàn)為呼吸窘迫���、頑固性低氧血癥和呼吸衰竭���,為常見的危及人類健康的呼吸系統(tǒng)重癥表現(xiàn)之一。
多種危險因素可誘發(fā) ARDS��,主要包括:1)直接肺損傷因素:嚴重肺部感染�,胃內(nèi)容物吸入�����,肺挫傷���,吸入有毒氣體,淹溺����、氧中毒等;2)間接肺損傷因素:嚴重感染��,嚴重的非胸部創(chuàng)傷�,重癥急性胰腺炎,大量轉(zhuǎn)輸血����,體外循環(huán),彌散性血管內(nèi)凝血等�����。SARS-CoV����、MERS-CoV、SARS-CoV-2 以及流感病毒引發(fā)的 ARDS 也是導致患者死亡的主要原因之一���。
ARDS 早期的特征性表現(xiàn)為肺毛細血管內(nèi)皮細胞與肺泡上皮細胞屏障的通透性增高�����,肺泡與肺間質(zhì)內(nèi)積聚大量的水腫液�����,其中富含蛋白及以中性粒細胞為主的多種炎癥細胞��。中性粒細胞黏附在受損的血管內(nèi)皮細胞表面�����,進一步向肺間質(zhì)和肺泡腔移行�����,釋放大量促炎介質(zhì)�,如炎癥細胞因子等�,參與中性粒細胞介導的肺損傷。除炎癥細胞外�,肺泡上皮細胞以及成纖維細胞也能產(chǎn)生多種細胞因子��,從而加劇炎癥反應過程���。
凝血和纖溶紊亂也參與了 ARDS 的病程,ARDS 早期促凝機制增強��,而纖溶過程受到抑制���,引起廣泛血栓形成和纖維蛋白的大量沉積���,導致血管堵塞以及微循環(huán)結(jié)構(gòu)受損。流行病學調(diào)查顯示���,ARDS 是臨床常見危重癥����。2005 年研究顯示 ARDS 發(fā)病率為每年 59/10 萬����,較以往發(fā)病率顯著提高,明顯增加社會和經(jīng)濟負擔�����,甚至可與胸部腫瘤�����、獲得性免疫缺陷綜合征(AIDS)���、哮喘或心肌梗死等相提并論���。
近年來,SARS-CoV��、MERS-CoV�����、SARS-CoV-2 以及流感病毒世界各地的爆發(fā)性傳播導致了大量患者死亡�����,尤其是合并有基礎疾病的老年人����,因此,針對 ARDS 的研究具有較強的現(xiàn)實意義,ARDS 的研究領域也不局限于 COVID-19���,可拓展至更多的肺部感染因素��。目前���,STSA-1005 和 STSA-1002 單藥的非臨床研究比較充分,STSA-1005 注射液和 STSA-1002 注射液已開展的單藥 I 期臨床研究顯示安全性良好����,STSA-1002 和 STSA-1005 聯(lián)合用藥能夠抑制過度激活的髓性細胞(單核/巨噬細胞、中性粒細胞)�,且 STSA-1005 可減少髓性細胞的骨髓動員,STSA-1002 對改善患者血栓并發(fā)癥存在益處����,具有協(xié)同的潛力,為兩藥聯(lián)合治療重型�、危重癥新型冠狀病毒肺炎及后續(xù)擬拓展到 ARDS 的臨床研究提供了理論依據(jù)。
(2)實施主體���、當前研發(fā)階段及預計進展
STSA-1002 和 STSA-1005 聯(lián)合用藥的實施主體為舒泰神母公司和全資子公司 STAIDSON BIOPHARMA, INC.�����,已于 2022 年 8 月取得臨床試驗批準通知書(適應癥:治療重型���、危重癥新型冠狀病毒肺炎)����,目前處于臨床I期階段����,預計在 2023年上半年完成健康受試者臨床 I期試驗���,之后將向 FDA申請和溝通后續(xù)適應癥拓展至 ARDS 適應癥的具體事宜����,II 期預計最快在 2023 年下半年開展����,最快 2024 年下半年進入 III期。
(3)未來前景
ARDS 患者仍以機械通氣作為主要支持治療方式��,但這一手段通過呼吸機控制氣壓使肺泡擴張�����,可能造成肺泡壁損傷,進一步誘發(fā)機械通氣相關性肺損傷��。藥物治療主要包括液體管理�、糖皮質(zhì)激素、肺泡表面活性物質(zhì)等����,但仍存在未滿足的臨床需求,研發(fā)安全���、有效治療 ARDS 藥物仍具有重要意義�。
(二)項目實施的必要性
1�����、保障創(chuàng)新藥物研發(fā)投入�,加快創(chuàng)新藥物研發(fā)落地
公司所處的生物創(chuàng)新藥行業(yè)屬于資金密集型行業(yè)。創(chuàng)新藥臨床試驗監(jiān)管嚴格����,過程周期較長,試驗復雜����,對公司的資金投入有著較高要求�����。本次募集資金用于重點在研產(chǎn)品的臨床試驗推進�����,保障上述在研產(chǎn)品按照既定的臨床試驗計劃���,進入臨床治療應用�����,獲得臨床試驗結(jié)果�,完成創(chuàng)新藥物的完整研發(fā)過程。本項目成功實施后�����,將有效保障公司創(chuàng)新藥物的研發(fā)進程�,拓展公司在研藥物的臨床試驗廣度和深度,為公司實現(xiàn)更多可商業(yè)化的產(chǎn)品奠定基礎����。
2�����、增強公司核心競爭力����,鞏固公司競爭優(yōu)勢
公司所處的生物創(chuàng)新藥行業(yè)屬于技術密集型行業(yè)����,產(chǎn)品生命周期有限,技術迭代升級較快���。因此��,研發(fā)是創(chuàng)新藥企業(yè)的發(fā)展基石和核心競爭力�。創(chuàng)新藥企業(yè)為保持競爭優(yōu)勢���,不斷儲備拓展研發(fā)管線產(chǎn)品�����,增強研發(fā)的深度和廣度��,為持續(xù)增長����、增強核心競爭力提供保障。
公司自設立以來����,持續(xù)進行創(chuàng)新生物藥物產(chǎn)品的研發(fā),在發(fā)現(xiàn)及開發(fā)創(chuàng)新大分子生物藥的領域能力突出�����,能夠獨立進行發(fā)現(xiàn)及開發(fā)生物藥所需的靶點評估�����、機制研究����、驗證����、臨床在研藥品篩選以及功能學驗證等全流程發(fā)現(xiàn)及開發(fā)生物藥。本次募投項目對應的在研產(chǎn)品在作用機理和研發(fā)工藝方面均處于國內(nèi)領先水平����,國內(nèi)同靶點產(chǎn)品稀缺����,公司一旦研發(fā)成功將有效提升產(chǎn)品體系的競爭力�,創(chuàng)造新的增長點,并鞏固公司的技術優(yōu)勢�����,從而為公司的可持續(xù)發(fā)展提供創(chuàng)新動力����。
(三)項目實施的可行性
1、符合國家產(chǎn)業(yè)政策和行業(yè)發(fā)展方向
中國從多方面頒布鼓勵政策�����,支持并鼓勵生物藥的研發(fā)�,如 2017 年 10 月頒布了《關于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》,通過改革臨床試驗管理和加快審評審批等多方面鼓勵生物藥創(chuàng)新和生物類似藥研發(fā)�,2020 年,我國就創(chuàng)新藥的優(yōu)先審評審批�、專利補償、數(shù)據(jù)保護�����、臨床試驗規(guī)范(GCP)等頒布或者修訂了一系列的政策或規(guī)則,以支持創(chuàng)新藥的研發(fā)及生產(chǎn)�����。
經(jīng)修訂的《藥品注冊管理辦法》《藥品生產(chǎn)監(jiān)督管理辦法》《藥物臨床試驗質(zhì)量管理規(guī)范》及《生物制品注冊分類及申報資料》陸續(xù)生效���,對新藥研發(fā)�、注冊流程�、臨床試驗管理以及生產(chǎn)管理等環(huán)節(jié)進行了改革。2020 年 7 月�,國家藥品監(jiān)督管理局發(fā)布《突破性治療藥物審評工作程序(試行)》,對納入突破性治療藥物程序的藥物��,CDE 將優(yōu)先配置資源進行溝通交流�����,加強指導并促進藥物研發(fā)���。2021 年 5 月,《關于全面加強藥品監(jiān)管能力建設的實施意見》發(fā)布�,要求提高完善創(chuàng)新藥的審評機制。2021 年 6 月���,新修訂的《中華人民共和國專利法》生效�����,其中對在中國獲得上市許可的新藥相關發(fā)明專利給予了專利權(quán)期限補償�����,這一系列政策均對國內(nèi)創(chuàng)新藥的研發(fā)及上市生產(chǎn)銷售帶來了促進作用��。
2022 年 1 月 30 日���,《“十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃》正式出臺�����,把堅持創(chuàng)新引領作為基本原則����,把創(chuàng)新作為推動醫(yī)藥工業(yè)高質(zhì)量發(fā)展的核心任務����,加快實施創(chuàng)新驅(qū)動發(fā)展戰(zhàn)略,構(gòu)建開放創(chuàng)新生態(tài),提高創(chuàng)新質(zhì)量和效率���,加快創(chuàng)新成果產(chǎn)業(yè)化����,為醫(yī)藥工業(yè)持續(xù)健康發(fā)展打造新引擎��。
2����、技術實施具有可行性
公司是一家具有創(chuàng)新能力,涵蓋新藥研發(fā)�、生產(chǎn)和銷售的全產(chǎn)業(yè)鏈創(chuàng)新性生物制藥企業(yè),是國家級高新技術企業(yè)���。
公司經(jīng)過多年積累��,創(chuàng)新藥物研發(fā)體系構(gòu)建基本完成�,具有豐富的技術儲備���、專業(yè)的研發(fā)技術團隊�,對藥物設計���、篩選�����、細胞系構(gòu)建�、臨床前評價�、臨床評價、藥品生產(chǎn)和質(zhì)量控制��、產(chǎn)業(yè)化等進行系統(tǒng)化研究開發(fā)和迭代升級���。蛋白藥物方向�����,建立了多種達到業(yè)界領先水準的候選藥物篩選體系�����、計算機輔助藥物結(jié)構(gòu)優(yōu)化平臺�����、蛋白藥物工藝開發(fā)和中試放大平臺��、質(zhì)量研究及控制平臺����;基因治療藥物/細胞治療藥物方向,建立了遞送載體篩選及評價體系����、工藝開發(fā)
中試放大平臺、質(zhì)量研究及控制平臺����。同時,公司根據(jù)疾病治療領域設置對應的藥理毒理研究團隊和臨床研究及運營團隊����。以上各技術平臺的建立,有效支撐并推動公司的創(chuàng)新藥物研究工作���。在自身研發(fā)的基礎上���,公司積極開展與第三方專業(yè)機構(gòu)的技術合作,通過整合內(nèi)外部研發(fā)資源���,完成新產(chǎn)品開發(fā)和技術成果的轉(zhuǎn)化�����。
3��、人才可行性
公司產(chǎn)品和技術的持續(xù)性創(chuàng)新是以人為基礎的�����,組建了一支多元化的�����、具有國際視野并具備扎實的專業(yè)素養(yǎng)和豐富的藥物開發(fā)經(jīng)驗的專業(yè)團隊����。公司研發(fā)人員多畢業(yè)于國內(nèi)外知名醫(yī)學����、藥學、生物學專業(yè)院校�,或具有國際化大型制藥企業(yè)工作經(jīng)驗,截至 2022年 9月 30日����,公司現(xiàn)有研發(fā)人員 263人���,占員工總?cè)藬?shù)的比例達到 32.92%。其中碩士以上學歷人員 166 人��,占研發(fā)人員總?cè)藬?shù)的比例為63.12%��;博士以上學歷人員45人���,占研發(fā)人員總?cè)藬?shù)的比例為17.11%����。公司對研發(fā)團隊的高度重視及對研發(fā)投入逐年增長���,為研發(fā)項目和技術平臺的升級提供了持續(xù)的人才保障和資金保障�����。
4��、管理可行性
公司具備完善的生產(chǎn)和質(zhì)量管理體系�、供應商管理體系��、人力資源管理體系��,擁有一支穩(wěn)定、凝聚力強����,并擁有豐富的管理經(jīng)驗和多年生物制藥的行業(yè)經(jīng)驗的團隊。為了提高創(chuàng)新能力����,加強新技術�、新產(chǎn)品、新工藝的研究開發(fā)和管理�����,加快技術積累和產(chǎn)品升級�����,公司制定了完善的研發(fā)體系�,在項目立項管理、藥品注冊管理�、鼓勵技術創(chuàng)新、技術成果保護等方面建立了明確的規(guī)章制度��。此外��,公司與國內(nèi)外知名的醫(yī)藥企業(yè)、醫(yī)療機構(gòu)建立了穩(wěn)定的合作關系和成熟的合作機制���,通過合作協(xié)議明確約定了研發(fā)過程中各方的合作方式��、工作職責�����、保密義務�、款項支付�����、成果分配�,在臨床治療方面持續(xù)開展合作。
(四)項目與現(xiàn)有業(yè)務或戰(zhàn)略的關系
公司是一家具有創(chuàng)新能力��,涵蓋新藥研發(fā)�、生產(chǎn)和銷售的全產(chǎn)業(yè)鏈創(chuàng)新性生物制藥企業(yè)。本次募集資金投資項目緊緊圍繞公司主營業(yè)務展開���,是對公司現(xiàn)有研發(fā)能力的提升和擴充�,為公司實現(xiàn)中長期戰(zhàn)略發(fā)展目標奠定堅實的基礎。
隨著本次募投項目的實施�����,將進一步推進公司創(chuàng)新藥物的研發(fā)進程����、豐富在研藥物產(chǎn)品管線、增強研發(fā)實力���,拓展公司在研藥物的臨床試驗廣度和深度���,進一步提升公司的核心競爭力���,為公司實現(xiàn)更多可商業(yè)化的產(chǎn)品奠定基礎�����。
(五)項目效益分析
本次募投項目的實施�,將加快公司在研新藥研發(fā)進程�����,推動在研產(chǎn)品的盡快上市。由于藥品需要完成臨床試驗��、獲得新藥注冊批件和生產(chǎn)文號后再進行商業(yè)化����,還涉及產(chǎn)品生產(chǎn)、銷售推廣等多個領域��,因此本次募投項目無法單獨直接計算經(jīng)濟效益��。
(六)資金缺口的解決方式
本項目計劃投資規(guī)模為 73,125.00萬元���,其中計劃募集資金總額為 58,000.00萬元����。若本次發(fā)行募集資金不能滿足公司項目的資金需要����,公司將利用自籌資金或通過其他融資方式解決不足部分。
(七)項目涉及審批�����、批準或備案事項的情況
根據(jù)國家發(fā)改委發(fā)布的《企業(yè)投資項目核準和備案管理辦法》���,本次募集資金擬投入的創(chuàng)新藥物研發(fā)項目主要為處于臨床研究階段實施的藥物研發(fā)工作�����,不屬于需要發(fā)改委備案的固定資產(chǎn)投資項目����;同時,上述創(chuàng)新藥物研發(fā)項目不涉及生產(chǎn)建設活動��,不屬于根據(jù)《中華人民共和國環(huán)境影響評價法》和《建設項目環(huán)境影響評價分類管理名錄》等相關法律法規(guī)的規(guī)定需要進行環(huán)境影響評價的建設項目�。
此報告為正式報告摘取部分。需編制政府立項���、銀行貸款����、投資決策等用途可行性研究報告咨詢思瀚產(chǎn)業(yè)研究院�����。
免責聲明:
1.本站部分文章為轉(zhuǎn)載���,其目的在于傳播更多信息,我們不對其準確性、完整性�、及時性、有效性和適用性等任何的陳述和保證����。本文僅代表作者本人觀點,并不代表本網(wǎng)贊同其觀點和對其真實性負責��。
2.思瀚研究院一貫高度重視知識產(chǎn)權(quán)保護并遵守中國各項知識產(chǎn)權(quán)法律�����。如涉及文章內(nèi)容����、版權(quán)等問題,我們將及時溝通與處理���。









 美國亞利桑那州-記憶綿床墊生產(chǎn)基地擴建項目可行性研究報告
美國亞利桑那州-記憶綿床墊生產(chǎn)基地擴建項目可行性研究報告 江西宜春-高能量密度動力儲能(方形)鋰電池研發(fā)產(chǎn)業(yè)化項目可行性研究報告
江西宜春-高能量密度動力儲能(方形)鋰電池研發(fā)產(chǎn)業(yè)化項目可行性研究報告 水晶光電-臺州智能終端用光學組件技改項目可行性研究報告
水晶光電-臺州智能終端用光學組件技改項目可行性研究報告 廣西欽州-中偉股份北部灣產(chǎn)業(yè)基地三元項目一期可行性研究報告
廣西欽州-中偉股份北部灣產(chǎn)業(yè)基地三元項目一期可行性研究報告 中國天津-毫米波雷達研發(fā)中心建設項目可行性研究報告
中國天津-毫米波雷達研發(fā)中心建設項目可行性研究報告 中國重慶-國儲珞璜智慧物流園項目可行性研究報告
中國重慶-國儲珞璜智慧物流園項目可行性研究報告 安徽合肥-高性能微電子級聚酰亞胺膜材料項目可行性研究報告
安徽合肥-高性能微電子級聚酰亞胺膜材料項目可行性研究報告 廣東汕頭-生殖健康藥品整體升級項目可行性研究報告
廣東汕頭-生殖健康藥品整體升級項目可行性研究報告